
La maladie de Kawasaki
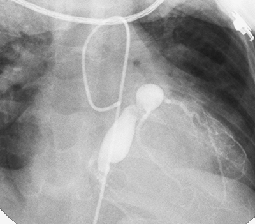 La maladie de Kawasaki est une maladie rare en Europe. Elle survient dans 50% des cas avant l’âge de 2 ans et la plupart du temps avant l’âge de 6 ans. La cause reste inconnue même si il est actuellement clair qu’il s’agit d’une réaction immunitaire très forte et inappropriée à un facteur extérieur (facteur infectieux? toxique?). Les patients avec maladie de Kawasaki ne sont pas contagieux et ce n’est pas non plus une maladie héréditaire, même si il existe probablement un terrain génétique prédisposant. Ceci expliquerait pourquoi la maladie est beaucoup plus fréquente chez les Japonais par exemple.
La maladie de Kawasaki est une maladie rare en Europe. Elle survient dans 50% des cas avant l’âge de 2 ans et la plupart du temps avant l’âge de 6 ans. La cause reste inconnue même si il est actuellement clair qu’il s’agit d’une réaction immunitaire très forte et inappropriée à un facteur extérieur (facteur infectieux? toxique?). Les patients avec maladie de Kawasaki ne sont pas contagieux et ce n’est pas non plus une maladie héréditaire, même si il existe probablement un terrain génétique prédisposant. Ceci expliquerait pourquoi la maladie est beaucoup plus fréquente chez les Japonais par exemple.
Symptômes
Les symptômes sont souvent très impressionnants. L’enfant présente une fièvre très importante, qui en général persiste plus de 5 jours. Cette fièvre ne répond évidemment pas aux antibiotiques. Les enfants sont très plaintifs et abattus. S’y associe généralement une conjonctivite (yeux rouges qui ‘piquent’), une chéleite (la bouche enflammée avec des lèvres craquelées), des éruptions cutanées suivi après une dizaine de jours d’une desquamation des doigts et des orteils. A l’examen clinique, le médecin retrouve de nombreux ganglions gonflés (adénopathies). Chez les enfants de moins d’1 an, ces signes cliniques peuvent être très peu marqués voir absents.
L’inflammation peut atteindre le cœur et les vaisseaux, en particuliers les artères coronaires. L’inflammation du cœur (endocardite, myocardite, péricardite) est généralement parfaitement réversible. L’inflammation des vaisseaux l’est nettement moins. En effet les vaisseaux enflammés peuvent se dilater de façon plus ou moins importante avec parfois formation d’anévrisme (importante dilatation). Ils peuvent également se rétrécir ou se boucher. Les anévrismes peuvent favoriser l’apparition de caillots de sang (thrombus). Toutes ces lésions peuvent compromettre la circulation du sang vers le cœur et favoriser l’infarctus du myocarde. Les enfants de moins d’1 an, chez qui par ailleurs les signes cliniques autres (fièvre, éruptions…) peuvent être beaucoup plus frustres, sont plus à risque de lésions sévères des artères coronaires.
L’inflammation peut également atteindre d’autres organes comme le tube digestif, les reins, le système nerveux central etc. Au niveau de ces différents organes, les lésions sont généralement réversibles.
Diagnostic
Le diagnostic est avant tout clinique. Cela veut dire que tout médecin doit y penser en présence d’une fièvre de longue durée accompagnée d'autres symptômes cités ci-dessus. Cependant ce diagnostic peut être difficile, surtout chez le petit enfant chez qui la présentation clinique est souvent frustre. Il n’existe malheureusement pas de test ‘spécifique’ de cette maladie. Dans la prise de sang la présence de plaquettes sanguines très élevées est toutefois en faveur du diagnostic. Au niveau cardiologique, l’échocardiographie et l’électrocardiogramme permettent de détecter une atteinte du cœur et des artères coronaires.
Traitement
Le traitement comprend en phase aigue l’administration intraveineuse de gammaglobulines. Ce traitement doit être administré le plus tôt possible. Dans ces conditions, il est démontré qu’il permet de fortement baisser le risque de séquelles au niveau des artères coronaires. Ce traitement est associé à des fortes doses d’aspirine, tant que l’enfant est fébrile ou que la prise de sang montre des signes inflammatoires importants. Un petit pourcentage des enfants nécessite une deuxième infusion de gammaglobulines ou d’autres médicaments intraveineux anti-inflammatoires très puissants afin de maitriser cette réaction inflammatoire très forte et inappropriée. Une fois la fièvre et l’inflammation maitrisée, un traitement par aspirine à petites dose est en général poursuivi au moins jusqu’au contrôle échocardiographique de 6-8 semaines. Si ce contrôle ne montre pas de lésions coronaires, ce qui est le plus souvent le cas, l’aspirine peut être arrêté et l’enfant considéré comme guéri. Dans les cas plus rares de lésions coronaires importantes dès le départ ou de lésions persistantes à 6-8 semaines, le traitement par aspirine est maintenu afin de favoriser la fluidité du sang. Si des anévrismes coronaires sont présents, un traitement anticoagulant est prescrit pour prévenir les caillots. D’autres médicaments, similaires à ceux utilisés chez l’adulte avec atteinte coronaire, peuvent s’avérer nécessaires. Ces enfants avec atteinte coronaire doivent être suivis régulièrement, et ceci à vie. Des bilans complémentaires extensifs (ex : coronarographies, résonance magnétique, épreuves d’effort, scintigraphies…) sont nécessaires à des intervalles variables en fonction de l’atteinte coronarienne, afin de mieux apprécier les lésions et leur conséquences. Dans les cas d’atteinte sévère, les activités sportives doivent être limitées. De rares enfants nécessitent des traitements par cathétérisme interventionnel (dilatation des coronaires) ou par chirurgie (pontage coronarien). Une bonne hygiène de vie (lutter contre le tabagisme, contre l’hypertension artérielle, contre l’obésité, contre l’hypercholestérolémie…) s’avère indispensable chez les patients avec atteinte coronaire, mais probablement également chez tous les patients ayant souffert d’une maladie de Kawasaki. Certaines équipes préconisent par ailleurs une épreuve d’effort systématique vers 8-10 ans chez tous les enfants ayant présenté une maladie de Kawasaki, même en l’absence de lésions coronariennes diagnostiquées à l’échocardiographie.
 retour vers "Maladies acquises"
retour vers "Maladies acquises"
Les myocardites ou inflammations du myocarde
La myocardite est une inflammation du muscle du cœur (myocarde). Lorsque l’inflammation du muscle est importante, le muscle n’est plus capable de se contracter normalement. On assiste donc à une diminution de la fonction cardiaque. Celle-ci peut dans un premier temps être peu sévère et ne pas donner lieu à des symptômes. Si l’atteinte est importante, des signes de défaillance cardiaque’ peuvent apparaitre.
Les causes de myocardite sont nombreuses.
- Les causes infectieuses sont les plus fréquentes. Plusieurs virus peuvent être responsables, citons les coxsackie B, adénovirus, parvovirus B19, echovirus, Epstein Barr virus (mononucléose), etc. Le virus HIV (SIDA) peut également engendrer une myocardite. Plus rarement, en tout cas chez l’enfant et en Europe, des bactéries, des parasites ou des champignons peuvent être la cause de myocardites.
- Certains toxiques (cocaïne, arsenic …) ou médicaments peuvent causer des myocardites.
- Certaines maladies auto-immunitaires comme le lupus érythémateux disséminé peuvent se compliquer de myocardite.
Symptômes
En cas d’atteinte significative du myocarde les symptômes de défaillance cardiaque peuvent apparaitre: fatigue anormale, intolérance aux efforts avec essoufflement important d’abord à l’effort puis également au repos. Des douleurs thoraciques, des palpitations peuvent être présentes. Des œdèmes des membres ou du visage peuvent apparaitre. En cas de myocardite virale, ces symptômes sont précédés par ceux de l’infection virale, c'est-à-dire fièvre, rhume, diarrhée, éruption etc.
Diagnostic
Le diagnostic peut être suspecté sur base des signes cliniques, mais ceci n’est pas toujours facile. Des signes cliniques de défaillance cardiaque, chez un enfant par ailleurs sain et ceci dans un contexte viral est très suggestif de myocardite. La radiographie du thorax, souvent faite dans ce contexte en raison de la fièvre, peut montrer une silhouette cardiaque élargie. L’électrocardiogramme et l’échocardiographie montrent les signes d’atteinte du muscle cardiaque avec élargissement des cavités et mauvaise fonction. La recherche de la cause de la myocardite n’est pas toujours aisée. Une bonne anamnèse (‘interrogatoire médical’) est indispensable. Des analyses sanguines, d’urines ou de selles peuvent trouver des stigmates de certaines infections ou ‘intoxications’ et peuvent parfois identifier le germe responsable.
Il est parfois difficile de différencier une myocardite aigue d’une cardiomyopathie dilatée préexistante, qui s’aggrave, par exemple à l’occasion d’une infection virale. Un prélèvement du muscle cardiaque (biopsie myocardique) peut être réalisé pour confirmer le diagnostic de myocardite et rechercher l’agent responsable.
Traitement
Tout enfant chez qui le diagnostic de myocardite est suspecté doit être hospitalisé car l’évolution peut être rapidement défavorable. Une surveillance rapprochée est donc toujours nécessaire. Le traitement est double : le traitement de la cause et le traitement de la défaillance cardiaque. En ce qui concerne la cause, des médicaments antiviraux, des antibiotiques, antiparasitaires ou antifongiques peuvent être nécessaires. Malheureusement, aucun médicament antiviral n’existe contre le coxsackie B qui est le virus le plus fréquemment en cause dans les myocardites virales. En cas de myocardite auto-immune, des médicaments anti-inflammatoires pourront maitriser l’inflammation. Ces médicaments anti-inflammatoires sont également utilisés par certaines équipes dans les myocardites virales, où l’inflammation provoquée par le virus est au moins aussi toxique pour le cœur que le virus lui même. Le traitement de la défaillance cardiaque sera variable en fonction de la gravité de l’atteinte. Si l’atteinte est peu sévère, un traitement oral par diurétiques et inhibiteur de l’enzyme de conversion est souvent suffisant. En cas d’atteinte plus sévère, des médicaments intraveineux plus puissants, comme la dobutamine par exemple, qui soutiennent la fonction mécanique du cœur peuvent être nécessaires. Les enfants doivent alors être surveillés aux soins intensifs. Dans des cas plus rares de myocardite fulminante, une assistance circulatoire (ou ECMO) peut être nécessaire. Dans les cas extrêmes, une transplantation cardiaque urgente peut être nécessaire. Certains patients avec myocardite présentent des arythmies qui doivent être traitées les plus efficacement possible.
Pronostic
Le pronostic des myocardites est variable. L’inflammation du cœur peut se résorber lors de la disparition de l’agent causal, engendrant alors une guérison complète. Cependant, dans certains cas, l’inflammation prolongée engendre des séquelles irréversibles. Même après disparition de l’agent causal, le cœur garde une fonction contractile plus ou moins altérée. La myocardite évolue dans ce cas vers le tableau clinique de la cardiomyopathie dilatée. Ces patients doivent rester sous surveillance et sous traitement médical. En cas d’atteinte sévère persistante, la transplantation cardiaque peut être une option thérapeutique. Les arythmies peuvent être cause de malaises graves voir de mort subite et nécessitent donc un traitement très agressif.
 retour vers "Maladies acquises"
retour vers "Maladies acquises"
Les péricardites ou inflammations du péricarde
La péricardite est une inflammation du péricarde, c'est-à-dire du sac qui entoure le cœur (figure). L’inflammation aigue, qui est douloureuse, peut s’accompagner de production de liquide (épanchement péricardique), qui s’accumule alors autour du cœur et peut compromettre la fonction du cœur. En cas d’inflammation chronique, le péricarde peut s’épaissir et ainsi ‘engainer’ le cœur. Cette ‘gaine’ épaisse peut également empêcher le bon fonctionnement du cœur.
Figure : Le péricarde (gris clair) est un 'sac" qui entoure complètement le cœur.
Cause
Chez l’enfant, les péricardites aigues sont le plus souvent infectieuses ou auto-immunitaires. Les virus représentent la cause la plus fréquente. Les bactéries, par exemple le pneumocoque, peuvent également causer des péricardites. La tuberculose est une cause bien connue de péricardite aigue, pouvant devenir chronique. Elle est cependant devenue rare dans notre pays. Les maladies auto-immunitaires comme le lupus érythémateux disséminé ou la maladie de Still, sont une cause non négligeable de péricardite chez l’enfant et celle-ci peut par ailleurs être le premier signe de la maladie. D’autres causes plus rares sont les cancers, l’insuffisance rénale, les traumatismes, les causes toxiques y compris médicamenteuses. Après chirurgie cardiaque, où le chirurgien est obligé d’inciser le péricarde pour accéder au cœur, les patients peuvent occasionnellement dans le mois qui suit la chirurgie, présenter une inflammation aigue du péricarde avec le plus souvent accumulation de liquide (épanchement péricardique).
Symptômes
Parmi les symptômes de la péricardite aigue, la douleur est la plus caractéristique. Il s’agit d’une douleur rétrosternale, s’accentuant souvent à l’inspiration profonde et en position couchée. Elle s’atténue en position assise. En cas de péricardite virale, d’autres signes comme la fièvre, un rhume, une toux peuvent être présents. Lorsque la péricardite s’accompagne d’une accumulation importante de liquide autour du cœur, celui-ci peut empêcher le bon fonctionnement du cœur et des signes de défaillance cardiaque très aigues, sévères et menaçants peuvent apparaitre. On parle dans ces cas de tamponnade. En cas de péricardite chronique avec épaississement du péricarde, des signes de défaillance cardiaque tels les œdèmes des membres inférieurs ou l’intolérance avec essoufflement à l’effort peuvent se manifester.
Diagnostic
Le diagnostic de péricardite aigue virale est souvent clinique (anamnèse et examen clinique). Une radiographie de thorax et une échocardiographie peuvent détecter une éventuelle accumulation de liquide autour du cœur. L’électrocardiogramme montre des anomalies typiques. Si une cause virale est suspectée, la recherche étiologique est rarement effectuée car celle-ci est difficile (beaucoup de virus différents possibles). Si une autre cause est suspecté (bactérienne, tuberculeuse, cancéreuse…) une ponction du liquide peut être réalisée pour analyser le contenu. En cas de péricardite chronique, l’échocardiographie, le scanner ou la résonance magnétique peuvent visualiser le péricarde épais et objectiver les conséquences sur le fonctionnement du cœur.
Traitement
Le traitement de la péricardite aigue virale non compliquée consiste en du repos associé à des anti-inflammatoires et anti-douleurs. Si les cause est autre (bactérie, maladie auto-immune, cancers) un traitement spécifique est nécessaire. En cas d’accumulation de liquide dans le péricarde, les patients doivent être suivis régulièrement. Si la quantité de liquide est menaçante, une ponction évacuatrice (péricardiocentèse) doit être effectuée. En cas de péricardite chronique constrictive, la résection du péricarde (péricardectomie) peut être nécessaire.
 retour vers "Maladies acquises"
retour vers "Maladies acquises"
Les endocardites
L’endocardite est une inflammation de l’endocarde, qui est la fine couche de tissu qui recouvre l’intérieur du cœur et donc également les valves cardiaques. C’est donc la couche de tissu qui sépare le muscle cardiaque du sang circulant.
La cause de l’endocardite est en général infectieuse, le plus souvent bactérienne. Il existe beaucoup plus rarement des endocardites immunitaires, comme par exemple dans la maladie de Kawasaki ou dans le lupus érythémateux disséminé.
L’endocardite bactérienne survient le plus souvent lorsque des bactéries d’une autre partie du corps viennent via le sang, se nicher dans le cœur. Lorsque les bactéries s’installent sur le cœur, en particulier les valves, elles peuvent proliférer et détruire de façon très importante certaines parties du cœur et des valves. L’endocardite survient rarement sur un cœur strictement normal. Le plus souvent, il existe une malformation cardiaque prédisposante, comme par exemple une sténose valvulaire aortique sur bicuspidie ou une communication interventriculaire.
Pour qu’une endocardite voie le jour, il faut en général un passage d’une quantité importante de bactéries dans le sang. Ceci peut par exemple se voir en cas d’existence d’un abcès. Des exemples d’abcès à concentration bactérienne élevée sont par exemple les caries dentaires, les angines bactériennes, les abcès digestifs profonds, les infections de peau etc. … La présence prolongée de cathéters intraveineux, ou l’injection intraveineuse abusive et sans soucis d’hygiène de drogues par des toxicomanes peut également favoriser la survenue d’une endocardite, même sur un cœur normal. Les bactéries comme les streptocoques ou les staphylocoques sont fréquemment retrouvés comme agent causal.
Symptômes
Les symptômes peuvent être sournois. Il peut en effet s’agir d’une fièvre trainante, peu sévère et inconstante mais ne cédant pas. Cette fièvre peut s’accompagner progressivement d’une altération de l’état général avec inappétence, amaigrissement ou fatigue. Dans certains cas, les symptômes sont beaucoup plus aigues avec tableau infectieux très floride. Lorsque l’endocardite a abimé une structure valvulaire de façon importante causant par exemple une fuite importante d’une valve, des signes d’insuffisance cardiaque peuvent apparaitre de façon plus ou moins aigue.
Diagnostic
Le diagnostic est souvent suspecté par l’histoire clinique. Ainsi tout patient, avec un passé ‘cardiologique’ et qui présente une fièvre de longue durée, est suspect d’endocardite. Les analyses de sang à la recherche d’inflammation et de présence de bactéries dans le sang (hémocultures) sont indispensables. L’échocardiographie (éventuellement transoesophagienne) peut visualiser des amas de bactéries (végétations) ainsi que les lésions causées par les bactéries.
Traitement
Le traitement est long car il nécessite minimum 6 semaines d’antibiotiques spécifiques en intraveineux. La chirurgie cardiaque est parfois nécessaire pour enlever les végétations résistant aux antibiotiques et pour réparer les lésions causées.
Prévention
Dans un but de réduire le risque d’endocardite chez les patients présentant des lésions cardiaques, des recommandations importantes existent. Ces recommandations ont toutefois évoluées dans le temps, en fonction d’analyses et d’études poussées sur les causes et l’incidence de l’endocardite. Les recommandations internationales élaborées dans les années 80 et 90s partaient de l’hypothèse que les soins ou manipulations dans des endroits du corps hautement infectées par des bactéries comme par exemple les caries dentaires, les abcès etc. étaient une cause importante d’endocardite. Il était donc recommandé chez les patients porteurs de cardiopathies de prendre un traitement antibiotique avant ces procédures considérées à risque. Une distinction était toutefois faite entre les patients à haut risque, moyen risque et faible risque en fonction de la lésion cardiaque.
Ces recommandations ont toutefois été complètement modifiées en 2007, à la suite de longues études et analyses sur l’endocardite. Ces études ont montré que :
| - |
les gestes ‘chirurgicaux’ dans des zones fortement infectées comme par exemple les soins dentaires en cas de caries sont en réalité moins souvent responsables d’endocardite que les gestes quotidiens (par exemple se brosser les dents). |
| - |
l’administration des antibiotiques semble peu efficace pour prévenir le passage dans le sang des bactéries et donc l’endocardite. |
| - |
l’utilisation fréquente d’antibiotiques a plus d’inconvénients que d’avantages. |
Pour toutes ces raisons, l’administration d’antibiotiques avant un geste chirurgical en région infectée n’est plus indiquée qu’en cas de lésion cardiaque estimée à haut risque, c'est-à-dire
| - |
présence de valve artificielle (y compris les homogreffes) et après réparation valvulaire |
| - |
antécédents d’endocardite |
| - |
lésions congénitales cyanogènes non réparées |
| - |
lésions congénitales réparées moyennant la mise en place de matériel prosthétique soit par voie chirurgicale soit par voie de cathétérisme et ceci pendant les 6 mois suivant la procédure |
| - |
lésions congénitales réparées mais avec un shunt résiduel à proximité de matériel prothétique |
| - |
Transplantation cardiaque avec lésion valvulaire |
Dans ces cas, l’administration d’antibiotique est ponctuelle :
| - |
- au dessus du diaphragme : amoxycilline (50 mg/kg en une fois, adulte 2 gr) ou clindamycine, érythromycine, vancomycine |
| - |
en dessous du diaphragme : amoxycilline (50 mg/kg) + gentamycine (2 mg/kg) |
Dans les autres cas, l’administration systématique d’antibiotique avant les gestes chirurgicaux ou soins dentaires n’est plus indiquée.
Par contre, pour TOUS les patients, les recommandations suivantes sont importantes :
| - |
maintenir une excellente hygiène dentaire : |
| |
- brossage biquotidien des dents
- visite 2 fois par an chez le dentiste et ce dès l’âge d’un an
- éviter les sucreries et les boissons sucrées entre les repas ou au lit, juste avant d’aller dormir
- éviter de boire à la paille, éviter le miel ou autre sucreries sur la tétine
|
| - |
les infections bactériennes doivent être traitées par antibiotiques. Les infections virales (par exemple des voies respiratoires) ne nécessitent pas d’antibiotiques. |
 retour vers "Maladies acquises"
retour vers "Maladies acquises"
Le rhumatisme articulaire aigue avec valvulopathie rhumatismale
Le rhumatisme articulaire aigue (RAA) ou fièvre rhumatismale est une maladie inflammatoire qui survient comme complication d’une infection (de la gorge en général) par Streptocoques du groupe A. Il peut survenir lorsque cette infection a été non ou mal soignée. Cependant, le RAA est devenu très rare dans des pays très ‘médicalisés’ comme la Belgique. Il est cependant encore très fréquent dans des pays en voie de développement comme les pays d’Afrique par exemple.
Le RAA survient essentiellement entre 5 et 15 ans mais il peut également se voir chez l’adulte. Les symptômes du RAA surviennent quelques semaines après l’infection de la gorge. La réaction inflammatoire atteint les articulations, le cœur, la peau et parfois le cerveau et la moelle épinière. Au niveau du cœur, les lésions inflammatoires atteignent essentiellement la valve mitrale et la valve aortique. Les lésions cardiaques laissent souvent des séquelles contrairement aux lésions inflammatoires au niveau des articulations qui, elles, guérissent.
Symptômes
Les symptômes du RAA sont de la fièvre, des articulations douloureuses et gonflées, des éruptions cutanées, une fatigue et en fonction de l’atteinte cardiaque éventuellement un essoufflement à l’effort. Des mouvements anormaux (‘chorée de Sydenham’) peuvent également apparaître. Les symptômes surviennent endéans les 2-3 semaines après une angine qui se caractérise par de la fièvre, un mal de gorge, des adénopathies cervicales, une fatigue, parfois des douleurs abdominales (surtout chez le jeune enfant), des maux de tête etc. Parfois, l’infection initiale à Streptocoques A est très peu symptomatique.
Diagnostic
Le diagnostic repose sur l’association de certains signes cliniques. Il n’existe en effet pas de test spécifique de la maladie. Il faudra donc l’association de plusieurs signes cliniques (‘critères’) pour confirmer le diagnostic: les plus importants sont l’atteinte des articulations et du cœur. Une prise de sang peut mettre en évidence des signes d’infection récente à Streptocoque A (anticorps ASLO). Une échocardiographie peut détecter les lésions au niveau des valves. Il s’agit principalement d’épaississements, pouvant engendrer des défauts d’ouverture (sténoses mitrales par exemple) ou des défauts de fermeture des valves (insuffisance mitrale par exemple) ou les deux associés. Un électrocardiogramme peut mettre en évidence un retard de la conduction électrique entre les oreillettes et les ventricules (bloc atrioventriculaire du premier degré).
La principale complication du RAA est l’atteinte cardiaque. Lors d’un première épisode de RAA, à peu près la moitié des gens développe des atteintes cardiaques et certains en gardent des ‘cicatrices’ au niveau des valves. Lorsque les patients se réinfectent ultérieurement avec des streptocoques du groupe A, les lésions vont s’accentuer. Les valves deviennent alors de plus en plus épaisses avec sténose et/ou insuffisance valvulaire de plus en plus sévère. C’est la ‘maladie rhumatismale’ du cœur. Elle peut engendrer un tableau clinique de défaillance cardiaque.
Traitement
Le traitement comporte plusieurs aspects. D’abord, il faut combattre l’infection à streptocoques encore présente dans la gorge en donnant des antibiotiques appropriés (pénicilline ou dérivés). Ensuite, un traitement anti-inflammatoire est généralement prescri t pour traiter les symptômes. Pour les symptômes articulaires, ce sont essentiellement des anti-inflammatoires non stéroïdiens qui sont administrés. En cas d’atteinte cardiaque sévère, c’est en général de la cortisone qui est recommandé (anti-inflammatoire stéroïdien). Après l’épisode aigue il faut également instaurer un traitement antibiotique préventif (pénicilline ou dérivés) soit par injections intramusculaires mensuelles soit par antibiothérapie orale quotidienne. Une surveillance cardiologique régulière est également indispensable associée dans certains cas à un traitement oral de la défaillance cardiaque. En cas d’atteinte sévère des valves un traitement interventionnel, soit par cathétérisme cardiaque (en cas de sténose mitrale) soit plus souvent par chirurgie (plastie ou remplacement valvulaire), peut être requis.
 retour vers "Maladies acquises"
retour vers "Maladies acquises"
L’hypertension artérielle pulmonaire
L’hypertension artérielle pulmonaire (HTAP) signifie une pression trop élevée dans les poumons. Cette hypertension artérielle pulmonaire est liée à une augmentation des résistances des petits vaisseaux pulmonaires (artérioles). Normalement, ces artérioles sont des vaisseaux à parois fines et souples, laissant facilement passer le sang et offrant donc peu de résistance à l’écoulement du sang. En cas d’hypertension artérielle pulmonaire, les parois de ces artérioles s’épaississent et se rigidifient. Ceci engendre une ‘résistance’ au passage du sang. Les résistances pulmonaires augmentent et donc par conséquence les pressions pulmonaires. Cet épaississement peut dans un premier temps être lié essentiellement à une contraction des muscles des parois. A ce stade, certains médicaments peuvent agir sur ces muscles et réduire l’augmentation des résistances. A un stade plus avancé, s’y ajoute un épaississement des parois par fibrose ou en quelque sorte ‘cicatrisation’ excessive. A ce stade là, les médicaments ne parviennent plus à réduire les résistances pulmonaires même s’ils peuvent quand même améliorer la tolérance cardiaque à cet excès de pression.
Il y a plusieurs causes possibles à l’hypertension artérielle pulmonaire. Elle peut être secondaire à certaines malformations cardiaques, comme par exemple dans la maladie d’Eisenmenger qui est abordé dans le chapitre des cardiopathies chez l’adulte. Elle peut être secondaire à des maladies de poumons ou des maladies plus générales (par exemple les maladies auto-immunitaires ou certaines anomalies de la coagulation) affectant également les poumons. Elle peut ne pas avoir de cause connue, c’est ce que l’on appelle ‘l’hypertension artérielle pulmonaire essentielle ou idiopathique’.
Symptômes
Les symptômes principaux sont un essoufflement d’abord à l’effort puis également au repos. Chez l’enfant, la croissance staturo-pondérale peut être ralentie. Des malaises essentiellement à l’effort, souvent graves et pouvant mener au décès du patient peuvent survenir chez les patients avec hypertension artérielle pulmonaire sévère. Si les patients ont au niveau du cœur une communication persistante entre le cœur droit et le cœur gauche, par exemple une communication interauriculaire, interventriculaire ou un foramen ovale, le sang passe via la communication, du cœur droit vers le cœur gauche avec comme résultat une cyanose.
En cas de suspicion clinique d’hypertension artérielle pulmonaire, une mise au point très exhaustive est nécessaire. L’échocardiographie et l’électrocardiogramme permettent en général de confirmer la présence de pressions pulmonaires élevées. L’étude échocardiographique détaillée est nécessaire pour estimer la sévérité et la tolérance du muscle du ventricule droit. Un cathétérisme cardiaque complète le plus souvent cette étude. Lors de ce cathétérisme, la mesure exacte des pressions pulmonaires et des résistances pulmonaires est possible. Il permet également d’étudier la réponse à certains médicaments et donc la part de ‘réversibilité’ de l’hypertension artérielle pulmonaire. Un test de marche de 6 minutes et une épreuve d’effort permettent d’évaluer les conséquences fonctionnelles. Une étude pulmonaire par scintigraphie, des épreuves fonctionnelles respiratoires, un scanner thoracique et parfois une biopsie pulmonaire permettent de mieux étudier les modifications pulmonaires, soit à l’origine de l’hypertension pulmonaire, soit comme conséquence du processus pathologique. Des analyses sanguines à la recherche de maladies auto-immunitaires ou d’anomalies de la coagulation, pouvant être la cause de l’hypertension pulmonaire sont indispensables si aucune autre cause n’est détectée.
Traitement
Le traitement de l’hypertension pulmonaire est essentiellement médicamenteux. Les poussées aigues d’hypertension pulmonaire sont traitées par inhalation de monoxyde d’azote (NO), puissant ‘vasodilatateur’ (qui dilate les vaisseaux) pulmonaire. Le traitement chronique est variable en fonction de la sévérité. Lorsque l’hypertension artérielle pulmonaire répond aux vasodilatateurs lors du cathétérisme cardiaque (10% des patients), un traitement par inhibiteurs calciques peut être administré. Pour les non-répondeurs, d’autres médicaments vasodilateurs plus puissants sont prescrits comme le Sildénafil (Viagra®) ou le Bosentan (Tracleer®). En cas de diminution d’efficacité de ces médicaments, des infusions continues de prostaglandines peuvent être administrés. Ce dernier médicament nécessite la mise en place d’un Port-à-cath® ou d’un Broviac®, deux systèmes permettant un accès veineux continue de longue durée. Ces médicaments peuvent être administrés à domicile mais nécessitent une surveillance rapprochée par une infirmière à domicile et un apprentissage des manipulations, qui doivent respecter une stérilité stricte, par les parents. Parfois, lorsque le patient fait des malaises, la création ou l’élargissement par cathétérisme cardiaque d’une communication interauriculaire peut être préconisée. En cas de réponse insuffisante à ces différents traitements la seule option reste la transplantation pulmonaire +/- cardiaque. Chez la femme, la présence d’une hypertension pulmonaire modérée ou sévère est une contre-indication à une grossesse. L’hypertension artérielle pulmonaire est une maladie qui progresse dans le temps, même en cas de traitement. Aucun traitement, à l’heure actuelle, ne permet d’arrêter le mécanisme pathogénique.
 retour vers "Maladies acquises"
retour vers "Maladies acquises"
L’hypertension artérielle chez l'enfant
L’hypertension artérielle (HTA) signifie une pression trop élevée dans l’aorte. Alors qu’il s’agit d’une pathologie très fréquente chez l’adulte, elle est peu fréquente chez le jeune enfant. Contrairement à l’adulte, où l’hypertension artérielle est la plupart du temps ‘essentielle’ (càd sans réelle cause mais plutôt en rapport avec un ensemble de facteurs favorisants comme l’hérédité, le surpoids, le tabac etc …), chez le jeune enfant, l’hypertension artérielle est quasi toujours secondaire soit à une maladie cardiovasculaire (ex : coarctation de l’aorte, hypoplasie artérielle par exemple dans le syndrome de Williams), soit à une maladie rénale, une maladie endocrinienne ou une cause médicamenteuse (ex : cortisone). A partir de la seconde décennie, l’hypertension artérielle essentielle devient plus fréquente, en particulier dans la race noire, chez les patients obèses ou en présence d’un facteur héréditaire important. L’obésité devenant un problème de société majeur, y compris chez l’enfant et l’adolescent, l’hypertension artérielle devient un problème plus fréquemment rencontré par le cardiopédiatre.
La mise au point nécessite chez l’enfant, surtout lorsqu’il est jeune, la recherche d’une cause. Une exploration cardiologique minutieuse (échocardiographie et mesure des tensions artérielles aux 4 membres), une exploration rénale (échographie rénale, analyses sanguines, parfois scanner abdominal) et une exploration endocrinienne (analyses de sang et d’urines dans un premier temps) sont effectuées. L’histoire familiale est également importante.
L’évaluation de la sévérité de l’hypertension artérielle chez l’enfant se fait par la mesure de la tension artérielle pendant 24 heures (MAPA). Une échocardiographie cardiaque et un électrocardiogramme à la recherche de signes d’épaississement du muscle du ventricule gauche, secondaire à l’excès de tension artérielle est également nécessaire.
Traitement
Le traitement dépend essentiellement de la cause. Nombreux médicaments utilisés chez l’adulte pour contrôler la tension artérielle peuvent être utilisés chez l’enfant, comme les bétabloquants, les inhibiteurs de l’enzyme de conversions, les inhibiteurs calciques, les diurétiques etc…., avec toutefois, il va des soi, des dosages ajustés au poids et à la taille de l’enfant !
 retour vers "Maladies acquises"
retour vers "Maladies acquises"