
4
. La tétralogie de Fallot et lésions similaires
Description
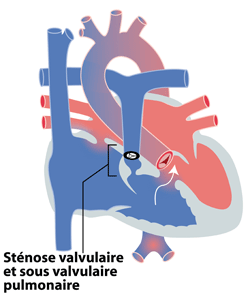 C’est Arthur Fallot (France) qui le premier, en 1888 décrit la tétralogie ou ‘maladie bleue’, rassemblant une communication interventriculaire (CIV), une aorte à cheval sur le ventricule droit et gauche, une hypertrophie (épaississement) du ventricule droit et un obstacle au niveau de la voie d‘éjection du ventricule droit. Cet obstacle peut se situer au niveau de la valve pulmonaire (sténose valvulaire), en dessous ou au-dessus de la valve pulmonaire (sténose sous- ou supra-valvulaire pulmonaire), au niveau des artères pulmonaires ou partout à la fois (figure 1). Cette anatomie favorise le passage du sang bleu, via la CIV vers l’aorte où il se mélange au sang rouge, générant ainsi une cyanose (aspect ‘bleue’).
C’est Arthur Fallot (France) qui le premier, en 1888 décrit la tétralogie ou ‘maladie bleue’, rassemblant une communication interventriculaire (CIV), une aorte à cheval sur le ventricule droit et gauche, une hypertrophie (épaississement) du ventricule droit et un obstacle au niveau de la voie d‘éjection du ventricule droit. Cet obstacle peut se situer au niveau de la valve pulmonaire (sténose valvulaire), en dessous ou au-dessus de la valve pulmonaire (sténose sous- ou supra-valvulaire pulmonaire), au niveau des artères pulmonaires ou partout à la fois (figure 1). Cette anatomie favorise le passage du sang bleu, via la CIV vers l’aorte où il se mélange au sang rouge, générant ainsi une cyanose (aspect ‘bleue’).
Figure 1 : tétralogie de Fallot
Dans certains cas, la valve pulmonaire ne s’ouvre pas du tout. On parle alors de tétralogie de Fallot avec atrésie de la valve pulmonaire. La persistance du canal artériel y est indispensable pour permettre le passage de sang vers les poumons.
Une autre variante est appelée la tétralogie de Fallot avec ‘agénésie de la valve pulmonaire’. Dans ce cas il n’y a pas de vraie valve mais des bourgeons qui font obstacle au passage du sang (sténose) et qui sont incapables d’empêcher le sang de refluer vers le ventricule droit (régurgitation). Cette sténose associée à la régurgitation importante génère déjà avant la naissance une importante dilatation des artères pulmonaires. Cette dilatation peut comprimer les voies aériennes de l’enfant (bronches et bronchioles) pouvant compliquer la prise en charge en période néonatale.
Les malformations cardiaques suivantes sont fréquemment associés à la tétralogie de Fallot : une communication interauriculaire, des communications interventriculaires additionnelles, un arc aortique droit c’est à dire faisant sa courbe vers la droite au lieu de la gauche, des anomalies des artères coronaires, un canal artériel encore perméable. Elle représente à peu près 10% des malformations cardiaques congénitales. Le plus souvent la tétralogie de Fallot est isolée, mais parfois, elle peut s’intégrer dans des syndromes (association de plusieurs anomalies cliniques): syndrome de Down ou trisomie 21, syndrome de microdélétion 22q11, syndrome de Goldenhar.
Le ventricule droit à double issue avec gros vaisseaux normalement posés et sténose pulmonaire (‘type Fallot’), est une malformation relativement proche anatomiquement et dans sa présentation clinique. Comme le nom le dit bien, les deux gros vaisseaux (aorte et artère pulmonaire) naissent principalement du ventricule droit alors que dans la tétralogie de Fallot, l’aorte, même si elle est à cheval sur les deux ventricules, nait principalement du ventricule gauche.
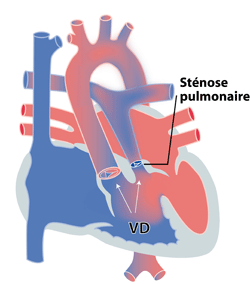
Figure 2 : ventricule droit à double issue
Les formes complexes de transposition des gros vaisseaux avec communication interventriculaire (CIV) et sténose pulmonaire peuvent également être reprises dans ce groupe. Dans cette malformation, l’artère pulmonaire sort du ventricule gauche, l’aorte du ventricule droit. La présence d’une CIV et d’un obstacle pulmonaire est responsable d’une présentation clinique très semblable à la tétralogie de Fallot.
Présentation clinique
Le mélange de sang rouge et de sang bleu au niveau de l’aorte engendre la cyanose ou aspect ‘bleu’ du patient. Cette ‘cyanose’ est cependant très variable d’un enfant à l’autre, en fonction du degré d’obstacle au niveau de la voie pulmonaire. S’il est peu important, le sang bleu arrive facilement dans les artères pulmonaires et se mélange donc peu au sang rouge : la cyanose est faible voire absente (Fallot ‘rose’). Lorsque l’obstacle est très sévère, la cyanose peut être très profonde car le sang bleu va préférentiellement vers l’aorte. Chez un même patient la cyanose peut varier d’un moment à l’autre. En général, la cyanose a tendance à s’accroître avec la croissance de l’enfant car la valve pulmonaire et les artères pulmonaires grandissent moins que le reste. Par ailleurs, l’obstacle en dessous de la valve (sténose sous-valvulaire pulmonaire), lorsqu’il existe, est essentiellement formé de muscle. Lorsqu’un patient s’énerve, pleure ou accélère son cœur pour d’autres raisons, le muscle a tendance à s’épaissir et à empêcher le passage du sang vers le poumon. Le patient peut alors devenir très bleu et même perdre connaissance par défaut d’oxygénation du cerveau. C’est ce qu’on appelle la ‘crise de Fallot’ ou crise ‘hypoxique’ (hypoxie = manque d’oxygène). Les crises hypoxiques peuvent également être favorisées par un bain chaud, de la fièvre etc …
A l’examen clinique un souffle cardiaque est présent en raison de l’obstacle au passage du sang au niveau de la voie pulmonaire. Ce souffle est plus important si l’obstacle est plus important. En cas de crise de Fallot sévère, ce souffle peut par contre diminuer voir disparaître en raison de la contraction du muscle sous la valve, empêchant parfois complètement le passage de sang.
En cas de tétralogie de Fallot ou ventricule droit à double issue avec atrésie pulmonaire, cette cyanose peut se manifester de façon brutale lors de la fermeture du canal artériel, c’est à dire quelques heures ou jours après la naissance. Une prise en charge médicale appropriée est alors urgente.
En cas de tétralogie de Fallot avec agénésie de la valve pulmonaire et importante dilatation des artères pulmonaires, les problèmes respiratoires peuvent être très importants et mener au diagnostic.
Diagnostic
Le diagnostic de la tétralogie de Fallot ou des malformations semblables peut se faire avant la naissance par échocardiographie fœtale. Comme pour les autres malformations, il est capital qu’un médecin expérimenté en échocardiographie fœtale exclue, dans la mesure du possible, des malformations cardiaques et non cardiaques associées importantes, car ceci peut profondément changer la prise en charge et le pronostic. En cas de diagnostic anténatal, il est souvent préférable que l’enfant naisse dans un centre qui dispose d’une équipe cardiologique pédiatrique, mais ceci est discutable en fonction de la ‘forme anatomique’.
Le diagnostic est cependant encore souvent fait après la naissance. L’échocardiographie permet le plus souvent un diagnostic très complet de la cardiopathie. Un électrocardiogramme et une radiographie du thorax font en général partie du bilan initial.
En cas d’atrésie pulmonaire associée il est parfois nécessaire de réaliser dans les premiers jours un cathétérisme cardiaque ou un scanner thoracique pour mieux décrire les artères pulmonaires qui peuvent être très petites (voire même absentes!) et mal visualisables en échocardiographie. Ces patients peuvent également présenter des collatérales aorto-pulmonaires, vaisseaux anormaux naissant de l’aorte, apportant du sang aux poumons lorsque les artères pulmonaires sont trop petites. Avant toute intervention, il est souvent utile de déterminer par cathétérisme ou scanner la localisation exacte et la taille de ces collatérales.
Le plus souvent, et surtout si d’autres anomalies non-cardiaques sont présentes, un bilan génétique à la recherche d’anomalies chromosomiques ou génétiques est réalisé.
Prise en charge médicale
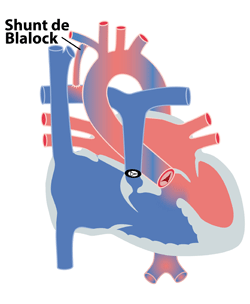 En cas de sténose pulmonaire très sévère ou en cas d’atrésie pulmonaire associée, les enfants nécessitent une prise en charge rapide, dès les premiers jours de vie. En effet, lors de la fermeture du canal artériel une cyanose très profonde peut s’installer pouvant être dangereuse. L’administration urgente de prostaglandine E (prostin®) permet de maintenir ouvert ou de rouvrir le canal artériel. Le chirurgien interpose dans les suites, entre l’aorte et l’artère pul-monaire un petit tuyau en Goretex® (shunt de Blalock, figure 3) permettant d’assurer une perfusion suffisante des poumons même après fermeture du canal. Celle-ci permet à l’enfant et aux artères pulmonaires de grandir et de proposer la correction chirurgicale dans de meilleures conditions. Dans certains cas, cette chirurgie peut être remplacée par la mise en place par cathétérisme cardiaque d’un stent dans le canal artériel, le maintenant ainsi ouvert malgré l’arrêt des prostaglandines.
En cas de sténose pulmonaire très sévère ou en cas d’atrésie pulmonaire associée, les enfants nécessitent une prise en charge rapide, dès les premiers jours de vie. En effet, lors de la fermeture du canal artériel une cyanose très profonde peut s’installer pouvant être dangereuse. L’administration urgente de prostaglandine E (prostin®) permet de maintenir ouvert ou de rouvrir le canal artériel. Le chirurgien interpose dans les suites, entre l’aorte et l’artère pul-monaire un petit tuyau en Goretex® (shunt de Blalock, figure 3) permettant d’assurer une perfusion suffisante des poumons même après fermeture du canal. Celle-ci permet à l’enfant et aux artères pulmonaires de grandir et de proposer la correction chirurgicale dans de meilleures conditions. Dans certains cas, cette chirurgie peut être remplacée par la mise en place par cathétérisme cardiaque d’un stent dans le canal artériel, le maintenant ainsi ouvert malgré l’arrêt des prostaglandines.
Aujourd'hui certains enfants peuvent bénéficier dès la naissance d'un élargissement chirurgical de la voie pulmonaire ou de la mise en place d’un stent dans la voie d’éjection du ventricule droit, par cathétérisme.
Figure 3 : shunt de Blalock en cas de tétralogie de Fallot.
La plupart des enfants avec tétralogie de Fallot et autres malformations semblables ne nécessitent cependant pas de traitement à la naissance. Beaucoup sont bien ‘équilibrés’ avec une cyanose modérée, bien tolérée, n’empêchant pas le bon développement de l’enfant. Parfois, avec le temps les crises de Fallot peuvent devenir plus fréquentes. L’enseignement aux parents de petits ‘trucs’ permettant de prévenir ou d’arrêter ces crises est capital. Ces petits moyens sont par exemple: éviter les pleurs intenses ou prolongées, éviter les bains trop chaud, en cas de crise débutante calmer l’enfant, appuyer sur le ventre du bébé avec les jambes du bébé pliées, etc. Cette dernière mesure permet par plusieurs mécanismes de favoriser le passage du sang vers les poumons et de donc de rendre l’enfant moins cyanosé. Les grands enfants (non opérés) adoptent par ailleurs spontanément la position du ‘squatting’ (accroupissement) lorsqu’ils font une crise hypoxique, pour les mêmes raisons. L’administration régulière de médicaments de type bêtabloquants (propanolol – Inderal®) peut prévenir la survenue de ces crises, en agissant sur le muscle sous la valve pulmonaire, muscle responsable des crises hypoxiques. Cependant, il est important de savoir que lorsque l’enfant fait une crise de Fallot sévère et que les parents ne peuvent l’arrêter par les ‘petites mesures’, il est indispensable de se rendre rapidement vers un centre médical spécialisé pour un traitement approprié. Celui-ci comprend généralement l’administration d’un calmant (benzodiazépines, par exemple Valium® ou équivalent), l’injection en intraveineux de bêtabloquants et parfois d’autres médicaments favorisants le passage de sang vers les poumons. La survenue d’une vraie crise hypoxique sévère est généralement une indication de traitement chirurgical de façon plus ou moins urgente. Si l’enfant est trop petit pour une correction complète ou que l’anatomie n’y est pas favorable, un shunt de Blalock est réalisé.
La correction chirurgicale de la tétralogie de Fallot et malformations similaires est actuellement proposée dès 6 mois de vie, mais parfois plus tôt si l’enfant est très symptomatique et que le poids et la forme anatomique sont favorables. La correction implique la fermeture de la communication interventriculaire par un patch (le plus souvent en matériel synthétique) et l’ouverture de la voie pulmonaire (résection de la sténose sous-valvulaire et supra-valvulaire pulmonaire, ouverture de la valve pulmonaire) (figure 4). Si la valve pulmonaire est vraiment très petite, celle-ci doit parfois être remplacée par une valve de donneur (homogreffe) ou d’animal (hétérogreffe). Cette intervention est une chirurgie à cœur ouvert sous assistance circulatoire.
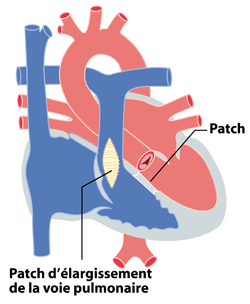 |
Figure 4 : correction chirurgicale de Tétralogie de Fallot
Les risques de ces différentes interventions sont actuellement faibles avec une mortalité < 2%. Ces chiffres doivent cependant être nuancés en fonction de l’âge du patient et de la forme anatomique. Une fois passée l’intervention, la plupart des patients opérés de tétralogie de Fallot et malformations semblables ont une qualité de vie normale avec une bonne espérance de vie. La tolérance aux efforts est souvent bonne. Une nuance est à apporter pour les patients ayant dès le départ des artères pulmonaires très petites (‘hypoplasiques’). Même après chirurgie correctrice, si celle-ci est possible, le ventricule droit doit assumer un travail plus important que normalement, en raison du petit diamètre des artères, ce qui peut rendre ces patients peu tolérants à l’effort. La pratique du sport est autorisée chez la majorité des patients, en tenant compte de leurs limites. La pratique du sport à un niveau de haute compétition est toutefois à proscrire. Pour les femmes, des grossesses peuvent être envisagées chez la plupart des patientes, sous surveillance cardiologique. Un suivi cardiovasculaire régulier reste par ailleurs indispensable dans tous les cas ! Dans les 20 ans qui suivent l’opération initiale, 10-15% des patients nécessitent une nouvelle intervention. En effet, le chirurgien, lors de la première intervention, doit fréquemment élargir la valve pulmonaire, trop étroite au départ. Cet élargissement engendre une fuite de la valve. Cette fuite de la valve peut à la longue dilater et fatiguer le ventricule droit, causant une fatigue à l’effort et parfois des troubles du rythme (tachycardies) qui peuvent être sévères. Un remplacement de la valve pulmonaire par homogreffe ou hétérogreffe peut alors être proposé. Depuis quelques années, l’insertion de valves par cathétérisme cardiaque, donc sans intervention à cœur ouvert est possible dans cette situation. Même si l’expérience est encore réduite, les résultats sont très prometteurs.
Pour plus d'informations sur les traitements : voir le chapitre "TRAITEMENT des CARDIOPATHIES"