
Le cathétérisme interventionnel
Le principe et histoire

 Le cathétérisme (KT) interventionnel se pratique par l’introduction de sondes et de matériel divers dans la circulation sanguine pour effectuer des interventions au niveau du cœur et des vaisseaux. Comme le matériel est introduit dans les vaisseaux à travers la peau, on parle aussi de procédures endoluminales (càd accédant au cœur par la lumière des vaisseaux) ou percutanées (en perforant la peau). Le cathétérisme cardiaque interventionnel permet de nos jours d’éviter certaines interventions chirurgicales. Cependant, très souvent il est complémentaire à la chirurgie.
Le cathétérisme (KT) interventionnel se pratique par l’introduction de sondes et de matériel divers dans la circulation sanguine pour effectuer des interventions au niveau du cœur et des vaisseaux. Comme le matériel est introduit dans les vaisseaux à travers la peau, on parle aussi de procédures endoluminales (càd accédant au cœur par la lumière des vaisseaux) ou percutanées (en perforant la peau). Le cathétérisme cardiaque interventionnel permet de nos jours d’éviter certaines interventions chirurgicales. Cependant, très souvent il est complémentaire à la chirurgie.
Le KT interventionnel s’effectue dans la même salle de radioscopie que le KT diagnostique et l’enfant est préparé de la même manière (procédure sous anesthésie générale) Les voies d’abord et la technique d’introduction des sondes et du matériel sont identiques. L’échocardiographie transoesophagienne (ETO) est également utilisée pour guider certaines procédures. Le KT interventionnel implique une anticoagulation pendant les manœuvres afin d’éviter la formation de caillots dans les différentes sondes et de minimiser le risque d’accident embolique. La prophylaxie contre l’endocardite bactérienne est appliquée en début de manœuvre. La durée de l’examen est extrêmement variable en fonction du type d’intervention et de l’âge de l’enfant (interventions plus délicates chez le nourrisson). L’enfant est surveillé après l’intervention pendant au moins une heure en salle de réveil avant de retourner dans son unité de soins où il pourra être réalimenté assez rapidement. Il devra toutefois rester couché pendant quelques heures afin d’éviter que les points de ponction ne saignent. En cas d’interventions plus lourdes et surtout chez les bébés, la surveillance se fera parfois aux soins intensifs. L’enfant ne ressent en général aucune douleur après le KT interventionnel, parfois une gêne au point de ponction où peut se développer un hématome (« un bleu »), parfois spectaculaire, qui s’évacuera spontanément en quelques jours. Le lendemain, une échocardiographie, un ECG et parfois une radiographie du thorax seront effectués afin de vérifier l’efficacité du traitement. La durée du séjour à l’hôpital varie de 2 à 3 nuits, rarement davantage, sauf chez le nouveau-né qui est souvent plus malade avant et après la procédure. Après certaines procédures où des prothèses telles des stents ou des prothèses de fermeture de communications ont été mis en place, on conseille parfois un traitement anticoagulant ou antiagrégant de quelques mois, pour éviter la formation de caillots sur les prothèses non encore « endothélialisées » (recouvertes d’une couche cellulaire) et protéger l’enfant des complications emboliques tardives (complication très rare au demeurant).
 retour Le cathétérisme interventionnel
retour Le cathétérisme interventionnel
Les différentes interventions peuvent se regrouper comme suit :


1. La dilatation de valves cardiaques, d’artères ou de veines:
Lorsque les valves cardiaques ou les vaisseaux présentent ce que nous appelons des ‘sténoses’ (‘rétrécissements’), il est parfois possible de traiter la lésion par cathétérisme cardiaque. La sténose des artères ou veines correspond à une réduction de calibre du tuyau, càd un rétrécissement, empêchant par là un bon passage du sang.
 Dilatation des valves (valvuloplastie)
Dilatation des valves (valvuloplastie)
Les rétrécissements ou sténoses des valves aortiques et pulmonaires, peuvent se présenter à tous les âges. Une sténose valvulaire correspond à une valve qui ne s’ouvre pas bien lors du passage de sang parce que les feuillets en sont partiellement soudés ou malformés. En général, la malformation de la valve est présente dès la naissance, mais le degré de ‘sténose’ peut se majorer avec le temps, comme il peut parfois s’atténuer.
Lorsque la ‘sténose’ est ou devient trop sévère, ceci représente un travail excessif pour le ventricule gauche lorsqu’il s’agit de la valve aortique, et pour le ventricule droit lorsqu’il s’agit de la valve pulmonaire. On doit alors ‘remodeler’ la valvule (plastie valvulaire) afin que celle-ci puisse mieux s’ouvrir au passage du sang. On peut très souvent éviter la chirurgie en recourant à la valvuloplastie percutanée.
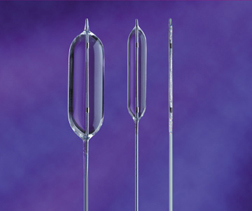
La valvuloplastie percutanée consiste à introduire dans le cœur un ballon de 2 à 4 cm de long fixé à une sonde (cathéter à ballon, dont l’âme contient le tuyau de gonflage accessible de l’extérieur). Le milieu du ballon dégonflé est placé à hauteur de la valve. Le diamètre du ballon est choisi d’après la mesure angiographique du diamètre de la valve. Le ballon est gonflé à l’aide d’un liquide radio-opaque, souvent à 2 ou 3 reprises, afin d’arriver à distendre, voire déchirer un peu la valve (figure). Le cathéter à ballon est ensuite retiré. On pourra ensuite par une injection de produit de contraste et par des mesures de pressions évaluer l’efficacité du geste. En général, le but est de ne pas ouvrir trop la valvule car les feuillets qui sont et resteront anormaux risqueraient de se mal fermer en diastole, engendrant une fuite trop importante de la valve (la valve fermée n’est plus étanche).
Ballons pouvant être utilisés pour la valvuloplastie
(Copyright NUMED)
La valvuloplastie percutanée de la valve pulmonaire est maintenant le traitement de choix, les récidives de la sténose étant très rares et les fuites peu sévères. Pour la valvule aortique, par contre, ce traitement est toujours palliatif car la valve anormale continue à se dégrader au cours du temps et il arrive un moment où il faut la remplacer, parfois par une valve mécanique nécessitant un traitement définitif aux anticoagulants ou alors par une homogreffe. Il est donc fort intéressant de pouvoir « gagner du temps » avec le KT interventionnel et de reculer à l’âge adulte le temps chirurgical pour que le petit patient puisse vivre une enfance sans entrave. Les sténoses très sévères des valves aortique et pulmonaire peuvent être très mal tolérées dès la naissance et nécessiter une intervention urgente dans la première semaine de vie : c’est dans ces cas particuliers que la valvuloplastie percutanée est la plus précieuse, car beaucoup mieux tolérée que la chirurgie chez ces bébés en très mauvais état hémodynamique.
 |
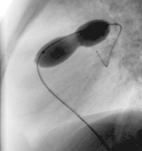 |
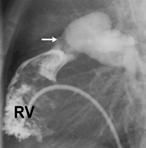
La figure montre un exemple de sténose valvulaire pulmonaire traitée par valvuloplastie percutanée. L’image de gauche montre l’injection de produit de contraste dans le ventricule droit (RV). Celle-ci permet de voir la valve pulmonaire (flèche blanche). Après mensuration, un ballon de diamètre adéquat est introduit, en suivant le même chemin, et gonflé à hauteur de la valve (image de droite), dégonflé puis retiré du cœur de l’enfant. |
En cas d’imperforation de la valve pulmonaire (atrésie pulmonaire) la valve pulmonaire est complètement soudée et le sang ne peut y passer. Le maintien du canal artériel perméable est indispensable par prostaglandines. Ensuite, si le ventricule droit est bien développé (ce qui n’est pas toujours le cas), on peut traiter ces enfants par KT interventionnel: on guide sous la valve imperforée une sonde par laquelle on place un fil d’acier contre la valvule (figure). Ce fil est chauffé par radiofréquence et on perfore ainsi la valve. On introduit ensuite une succession de ballons de taille croissante jusqu’à ouverture suffisante de la valve.
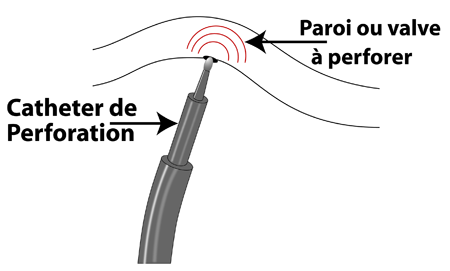 |
figure: principe de la perforation par radiofréquence: une sonde pouvant monter en température grâce au principe de la radiofréquence est appliquée sur la valve atrétique (plan valvulaire sans orifice). La chaleur émise va alors brûler la paroi et créer un petit trou qui sera ensuite dilaté par des ballons. |
En cas de sténose mitrale après maladie rhumatismale, la valvuloplastie percutanée peut s’avérer indiquée et efficace. Ceci est cependant très rare dans nos pays européens mais très fréquents dans les pays en voie de développement.
Implantation de valve pulmonaire sans chirurgie
On met au point depuis quelque temps une technique d’implantation de valvule pulmonaire par voie percutanée. En effet, la valvule pulmonaire est déficiente dans de nombreuses malformations et doit être modifiée ou remplacée en très bas âge, ce qui implique une ou plusieurs ré-opérations tardives pour remplacer la valve ou la prothèse, selon les cas. Il est donc intéressant de posséder une technique qui permettrait d’éviter ces ré-opérations, souvent lourdes pour le patient multi-opéré.
La technique est de conception relativement simple ( nous ne parlons pas ici de la réalisation…): on fixe à l’intérieur d’un stent une valve de jugulaire de veau ( on parlera de ‘stent valvé) et on enfile cet ensemble sur le ballon dégonflé d’un cathéter à ballon. On comprime le stent et la valve sur le ballon dégonflé pour que l’ensemble puisse entrer dans un introducteur percutané. La sonde et son chargement est placée classiquement dans l’anneau pulmonaire. On gonfle alors le ballon qui ouvre le stent et l’impacte dans la paroi pulmonaire (tout en comprimant la valve pendant cette phase). Lorsque le stent est en place, on dégonfle le ballon et la valve se déploie (figure). Cette technique est encore à ces débuts et n’est à ce stade utilisée que pour certaines indications et dans certaines institutions.
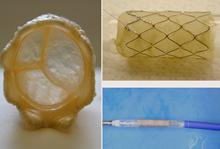 |
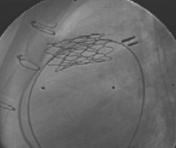 |
Figure: les différents éléments du stent valvé : à gauche, une valvule de jugulaire de veau dont on peut observer la délicate structure ; au centre et en haut, cette même valvule insérée dans le stent et au centre et en bas, l’ensemble comprimé et monté sur un cathéter à ballon, prêt à l’emploi. A droite: image radioscopique d’un stent valvé en position pulmonaire (vue de profil : le sternum + fils d’acier est à gauche et la colonne vertébrale est à droite). La valvule, non radio-opaque, est invisible. |
Implantation d’autres valves:
Utilisant le même principe que pour la valve pulmonaire, on met actuellement au point des techniques d’mplantation percutanée de valves aortiques et mitrales. Ces techniques sont prometteuses pour l’adulte âgé en mauvais état hémodynamique. Leurs possibilités d’utilisation en pédiatrie restent incertaines.
 Dilatation des artères et veines (angioplastie)
Dilatation des artères et veines (angioplastie)
Les rétrécissements ou sténoses des artères ou veines peuvent être congénitales (présentes dès la naissance) mais elles peuvent également être secondaires à une chirurgie (manque de croissance ou cicatrisation excessive à un endroit de suture). Comme pour les valves, les sténoses artérielles ou veineuses peuvent être peu importantes au départ, mais s’accentuer avec le temps. Lorsque celles-ci deviennent trop serrées, la circulation se fait mal et des complications sont prévisibles ; il faut donc agir sur le rétrécissement. En cas de sténose sur les artères pulmonaires, l’angioplastie percutanée est actuellement souvent utilisée comme traitement de première intention. En cas de coarctation de l’aorte, le choix du traitement dépend de plusieurs facteurs comme l’âge, l’anatomie etc.
L’angioplastie percutanée peut se faire par un cathéter à ballon, selon le même principe et la même technique que les dilatations valvulaires. Une fois le rétrécissement bien imagé par injection de produit de contraste, le ballon le mieux adapté est choisi (longueur, diamètre) Il est alors introduit jusqu’à la sténose, gonflé quelques fois, puis dégonflé et retiré (figure). On peut ensuite vérifier l’efficacité de la dilatation en mesurant les variations de pressions et en réinjectant du produit de contraste afin de visualiser le résultat obtenu.
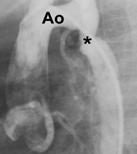 |
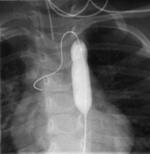 |
Figure: L’image de gauche montre un rétrécissement au niveau de l’aorte (Ao) descendante, encore appelé coarctation. La droite montre un ballon gonflé à hauteur du rétrécissement. |
Il arrive que la dilatation d’une artère ou d’une veine ne soit pas efficace : la lésion est « élastique » et après dilatation reprend son calibre initial. Il existe un moyen d’éviter cet inconvénient en fixant mécaniquement le diamètre du vaisseau dilaté à l’aide d’un stent ou prothèse endovasculaire. Un stent est un petit ‘treillis’ cylindrique en métal précieux (platinum, nitinol …) dont les mailles sont expansibles. Il est placé sous sa forme « comprimée » sur le ballon dégonflé d’un cathéter d’angioplastie (figure) et l’ensemble peut être introduit via l’introducteur dans le vaisseau d’accès. Le ballon est mis en place dans la zone rétrécie et est gonflé, réalisant ainsi l’expansion du stent qui s’incruste dans la paroi du vaisseau, créant une armature qui maintient la lumière du vaisseau largement ouverte. Le ballon est dégonflé et retiré, le stent lui restant définitivement en place. Il va de soi que les stents sont davantage utilisés chez les grands enfants, car ils fixent le calibre du vaisseau et ne permettent plus sa croissance. Certains stents peuvent toutefois être redilatés au fur et à mesure de la croissance de l’enfant. Enfin, cette technique du « stenting » des artères est la même que celle utilisée depuis un petit temps déjà pour traiter les rétrécissements coronaires de l’adulte.
 |
La figure de droite montre un ballon avec stent, d’abord non déployé et prêt à l’introduction dans les vaisseaux, ensuite déployé par le gonflement du ballon. |
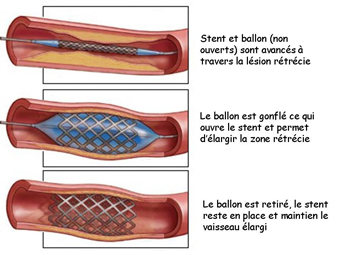 |
La figure montre le principe de l’angioplastie avec stent d’un segment rétréci. Le ballon incruste le stent sur la paroi et est ensuite retiré, laissant le stent en place. |
 retour Les différentes interventions
retour Les différentes interventions
2. La fermeture de communications ou vaisseaux anormaux :
Les communications intracardiaques les plus fréquentes sont les communications interauriculaires (CIA) et les communications interventriculaires (CIV). Ces lésions sont congénitales. Parfois elles sont créées à dessein par le chirurgien ou par le cathétériseur (voir chapitre suivant) dans des situations particulières pour soulager la circulation : par exemple lors des palliations des cœurs univentriculaires selon la technique de Fontan, il est parfois souhaitable d’établir une communication entre le circuit du sang veineux bleu et celui du sang rouge (fenestration, Fontan fenêstré).
La persistance du canal artériel est la communication intervasculaire la plus commune. Parmi les autres communications entre vaisseaux notons
- les fistules artério-veineuses systémiques (entre artère et veine), qui peuvent se situer à beaucoup d’endroits du corps et dont le fonctionnement excessif peut être cause de défaillance cardiaque
- les collatérales aorto-pulmonaires, naissant de l’aorte et destinées à la circulation pulmonaire, que l’on voit surtout dans les cardiopathies cyanogènes mais qui peuvent également se voire de façon isolée (séquestre pulmonaire)
- Les fistules artério-veineuses pulmonaires qui créent un court circuit entre l’artère pulmonaire et les veines pulmonaires et causent une cyanose. Ces dernières peuvent être congénitales ou apparaître après certaines chirurgies comme l’intervention de Haller (Glenn) ou intervention de Fontan.
Lorsque ces différentes communications sont larges ou si elles interfèrent d’une façon ou d’une autre avec le bon fonctionnement du cœur ou de la circulation, il faudra les fermer. De même, lorsque les communications créées par le chirurgien ou par le cathétériseur deviennent ‘superflues’ il peut être indiqué de les fermer. Ceci se fait de moins en moins par chirurgie et de plus en plus par KT interventionnel, tout en sachant que la chirurgie reste disponible en cas d’impossibilité de fermeture par cathétérisme.
 Fermeture percutanée de communication interauriculaire (CIA)
Fermeture percutanée de communication interauriculaire (CIA)
Le cathétérisme interventionnel ne permet de fermer que les communications interauriculaires de type ‘ostium secundum’, c’est à dire celles situées dans la partie centrale de la cloison interauriculaire, à distance des valves. Par ailleurs, la communication ne doit pas être trop large par rapport à la taille des oreillettes et il faut une ‘marge’ suffisante pour arrimer la prothèse. La technique n’est donc pas applicable dans tous les cas. Cependant, la proportion de cas récusés diminue avec l’amélioration constante des dispositifs mis sur le marché et l’expérience du cathétériseur.
La technique utilise une prothèse faite de 2 petits disques ou parapluies (figure). Les disques, variables selon le ‘constructeurs’ sont en général fait de 2 composés. D’une part les ‘baleines’, constitués de nitinol qui est un alliage de nickel et titane, très résistant et qui garde la ‘mémoire’ de la forme même après déformation extrême. D’autre part du tissu, qui assure une certaine étanchéité immédiate à la prothèse, et qui est en polyester. Ces prothèses sont très souples et peuvent être étirées à l’extrême, au point de pouvoir entrer dans l’âme d’un cathéter qui sera placé dans l’oreillette gauche (OG). Le premier disque/parapluie est déployé dans l’oreillette gauche (voir figure) et attiré tout contre le bord gauche du trou; le deuxième disque/parapluie est alors déployé, nécessairement dans l’oreillette droite et, attiré par son attachement au premier disque/parapluie, il bondit sur le bord droit du trou. Le dispositif de mise en place est ensuite désolidarisé de la prothèse et retiré par le cathéter. Les 2 disques sont donc placés sur le trou de part et d’autre de la paroi interauriculaire. Les 2 disques/parapluies tiennent en place par pincement des parois du trou. La bonne position de la prothèse est contrôlée par radioscopie (elle est radio-opaque) mais également par échocardiographie transoesophagienne .
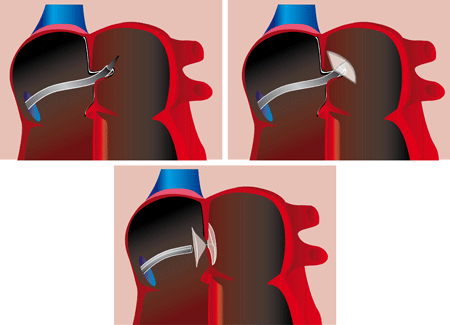 |
La figure montre les étapes de la procédure de fermeture percutanée : la prothèse, repliée dans le cathéter est avancée dans l’OG où le ‘parapluie gauche’ est libéré. Ensuite, après attraction du dispositif contre la paroi interauriculaire, la partie droite est déployée |
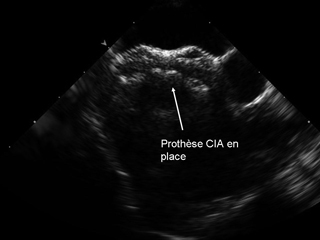 |
La figure montre l’image obtenue par échocardiographie transoesophagienne de la prothèse de CIA en place. |

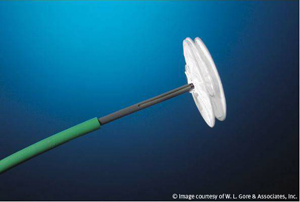
 Les figures montrent 3 types différents de prothèses fréquemment utilisées.
Les figures montrent 3 types différents de prothèses fréquemment utilisées.
Cette technique est également utilisée pour la fermeture des fenestrations après intervention de Fontan fenêstré (voir chapitre des ventricules uniques).
La technique de fermeture des communications interauriculaires de type ostium secundum par cathétérisme interventionnel a maintenant fait ses preuves et constitue le choix thérapeutique de première intention, la chirurgie étant réservée aux échecs de la voie percutanée ou aux CIA trop grandes ou avec bord insuffisant.
 Fermeture percutanée de communication interventriculaire (CIV)
Fermeture percutanée de communication interventriculaire (CIV)
Lorsque l’indication d’une fermeture de CIV est retenue, la chirurgie est encore à l’heure actuelle souvent le premier choix. Depuis peu cependant, certaines CIV peuvent, dans certains cas bien précis, faire l’objet d’une fermeture percutanée. Le principe de fermeture est le même que dans le cas des CIA mais les prothèses ont des formes et tailles différentes pour répondre aux caractéristiques particulières des CIV. Par ailleurs, la procédure est plus complexe car nécessite un passage des sondes dans le ventricule gauche et dans le ventricule droit.
Cette technique s’avère aujourd’hui surtout utile et indiqué pour le traitement des CIV résiduelles chez l’enfant déjà opéré ou dans les cas de CIV difficilement accessibles par le chirurgien (par exemple certaines CIV musculaires).
Les figures xa et xb montrent deux types de prothèses pour fermeture de 2 types différents de CIV, l’une située au milieu de la paroi (fig xa), l’autre située près de la valve aortique (fig xb)
 |
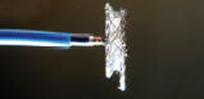 |
| Les figures montrent deux types de prothèses pour fermeture de 2 types différents de CIV, l’une située au milieu de la paroi (image de gauche), l’autre située près de la valve aortique (image de droite) |
 Fermeture de canal artériel (CA) et de fistules ou collatérales
Fermeture de canal artériel (CA) et de fistules ou collatérales
Les techniques de fermeture de CA et de fistules sont parmi les plus anciennes. En effet, les premières fermetures de canal artériel ont été décrites il y a plus de 15 ans et les techniques d’occlusion vasculaire sont utilisées depuis longtemps en radiologie interventionnelle. Les techniques ont bien évolué depuis lors et on dispose actuellement d’un matériel extrêmement performant. Grace à ces développements importants, la majorité des canaux artériels et des collatérales, en dehors de la période néonatale, peuvent être traités par cathétérisme cardiaque interventionnel, qui est ainsi devenu le traitement de premier choix. Ces techniques ne sont par contre pas encore utilisables chez le prématuré et le nouveau né avec large canal. Nous espérons que le développement de nouveaux dispositifs permettra à l’avenir également de traiter par KT interventionnels les petits bébés et prématurés, càd les patients qui souffrent le plus de cette condition et dont le traitement, jusqu’à présent, relève uniquement de la chirurgie.
Lorsque le CA ou la fistule est relativement petit, on utilisera en général des coils (figure) pour les obturer. Ces coils sont des minis tubes métalliques et élastiques préformés pour s’enrouler en plusieurs spires lorsqu’ils sont libérés. Le mini-tube lui-même est fait de métal non oxydable ou de platinum recouvert de fibres synthétiques. Le fabricant le livre dans sa forme étendue, dans une petite gaine de protection. Ceci permet l’introduction dans les cathéters. Une fois libéré, le coil prend la forme d’un cylindre à plusieurs spires (figure) et les fibres favorisent la formation d’un caillot, première étape de l’occlusion du vaisseau anormal. Certains sont simplement largués en les poussant à l’extrémité du cathéter avec un guide métallique, d’autres sont manipulables grâce à un dispositif qui permet de les récupérer si, une fois déployés, leur positionnement s’avère inadéquat.
Pour oblitérer les petits CA et les petites collatérales aorto-pulmonaires, un cathéter est introduit dans l’aorte afin d’injecter du produit de contraste, permettant de bien visualiser la localisation et la morphologie du CA ou de la collatérale. Le coil le plus adéquat est choisi en fonction de ces critères (plusieurs tailles possibles). Ensuite un autre cathéter, est introduit dans l’aorte puis dans le canal ou la collatérale. Le coil est introduit dans ce cathéter. Il est ensuite déployé dans le CA ou dans la collatérale. Dans le CA, le coil sera placé en partant de l’extrémité pulmonaire du CA vers l’extrémité aortique, faisant légèrement protrusion dans l’artère pulmonaire et l’aorte (une spire de chaque côté) afin d’assurer sa stabilité.
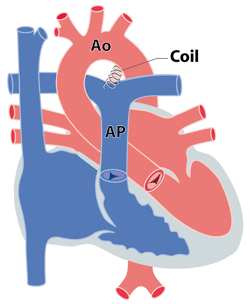


La figure de gauche montre le coil en place dans le canal artériel. Les figures du centre et de droite montre des coils dans la position ‘spiralée’ telle qu’ils seront dans le canal. On peut voir sur l’image du centre le pas de vis qui le retient à un câble. Le simple ‘dévissage’ permettra de libérer le coil lorsqu’il sera en bonne position
Les coils ne conviennent pas pour les CA ou collatérales larges. On utilise dans ce cas un autre type de prothèse comme par exemple le ‘duct-occluder®’, sorte de bouchon que l’on applique dans le canal ou la collatérale ou le ‘vascular plug®’ qui convient mieux au grosses collatérales (figure). La technique de mise en place est fort comparable à celle utilisée pour les coils, mais le matériel est plus encombrant et il n’est pas toujours utilisable chez les petits bébés en raison du petit calibre des voies d’accès.
 |
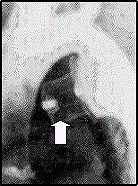 |
| La figure de gauche montre la prothèse utilisée pour la fermeture de larges canaux artériels. La figure de droite est une image angiographique montrant l’aorte après mise en place d’une prothèse dans le canal artériel : l’arche aortique est visualisée en blanc tandis que le ‘bouchon’ est le petit ‘chapeau haut de forme’(flèche) correspondant à la structure illustrée. |
 retour Les différentes interventions
retour Les différentes interventions
3. Création d’orifices
Certaines malformations ne sont viables après la naissance que s’il existe certaines communications entre les cavités cardiaques. C’est le cas par exemple dans la transposition des grands vaisseaux ou l’atrésie tricuspide. Dans ces deux malformations, le sang bleu doit pouvoir passer librement de l’oreillette droite vers l’oreillette gauche ou inversement pour accéder à la circulation pulmonaire et garantir un taux d’oxygène suffisant dans la circulation systémique. Il faut donc que le ‘foramen ovale’, présent avant la naissance reste largement ouvert. Ce foramen ovale a tendance à se fermer spontanément après la naissance et la survie du bébé est alors rapidement compromise. Il faut d’urgence recréer une large CIA. Anciennement, cette CIA était pratiquée par le chirurgien (intervention de Blalock-Hanlon) mais cette chirurgie, chez des enfants très cyanosé et en mauvaise santé, déplorait de fréquents échecs.
Dans les années soixante, William Rashkind mit au point une technique non chirurgicale simple de réouverture du foramen ovale qui révolutionna le pronostic de ces cardiopathies cyanogènes. Rashkind est par cela le véritable pionnier du cathétérisme interventionnel chez le nourrisson. Cette technique, qu’on appelle désormais septostomie au ballonnet selon Rashkind utilise un cathéter à ballon qu’on met en place dans l’oreillette gauche via la veine ombilicale ou la veine fémorale, en passant donc par l’orifice à élargir. On gonfle ensuite ce ballon puis on tire le cathéter avec le ballon gonflé de l’oreillette gauche vers l’oreillette droite. Ceci permet de déchire la paroi très mince à cet endroit (valve du foramen ovale). Cette manœuvre a sauvé de nombreux nourrissons en situation de cyanose extrême. Cette manœuvre, si l’urgence l’exige, peut se pratiquer en salle d’accouchement ou à l’unité de soins intensifs sous contrôle échocardiographique. Si l’enfant est stable, elle peut également s’effectuer en salle de KT sous contrôle radioscopique.
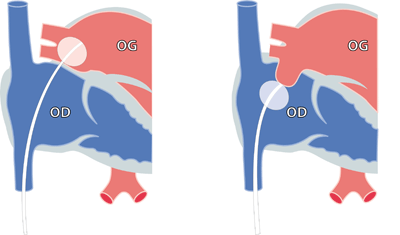 |
| La figure montre le principe de la septostomie au ballon: un ballon est introduit puis gonflé dans l’oreillette gauche. Il est ensuite tiré, tout en restant gonflé, vers l’oreillette droite. Ceci déchire la paroi entre les oreillette et aggrandit le trou. |
 |
| L’image montre un de ballons pouvant être utilisés pour la manœuvre de Rashkind |
En dehors de la période néonatale, il est également parfois amené à créer ou élargir une communication dans le septum interauriculaire. Ceci ne peut à ce moment là plus se faire par la manœuvre de Rashkind car passé quelques semaines de vie, le septum devient trop épais et ne se laisse plus déchirer par un ‘simple’ ballon. Plusieurs techniques existent. On peut s’il n’existe pas du tout de communication, en créer une avec une aiguille (ponction transseptale) ou ‘bruler’ un trou avec une sonde de radiofréquence dont l’extrémité chauffe la paroi sur une petite surface et créer comme ‘un trou de cigarette’. Ce trou devra être secondairement élargi. Ceci peut se faire avec une lame et avec des ballons de tailles croissantes. Pour éviter que le trou ne se referme rapidement, on place parfois un stent dans ce trou néoformé.
D’autres malformations nécessitent la persistance du canal artériel pour le bon fonctionnement du cœur. Pendant les premières semaines de vie, les prostaglandines administrés en intraveineux sont efficaces. Cependant, si cette nécessité se maintient, une autre solution doit être trouvée. Les chirurgiens peuvent mettre en place un shunt de Blalock, petit tube entre l’aorte et l’artère pulmonaire, qui joue donc le même rôle que le canal artériel. Actuellement il est également possible, dans certaines circonstances, de mettre un stent dans le canal artériel, ce qui permet de maintenir le canal artériel perméable, en tout cas pendant quelques mois.
 retour Les différentes interventions
retour Les différentes interventions
4. Biopsie myocardique
La biopsie myocardique consiste à prélever un petit morceau de muscle cardiaque pour analyse détaillée au laboratoire. Ceci est nécessaire pour vérifier l’absence de rejet après transplantation cardiaque. De même, en présence d’une cardiomyopathie dilatée ou hypertrophique ou en présence d’une myocardite, on est parfois amené à réaliser les biopsies myocardiques.
Les prélèvements sont en général faits au niveau du ventricule droit. On utilise pour ce faire des ‘sondes à biopsie’ qu’on introduit comme une sonde de cathétérisme, par le veine fémorale ou parfois par la veine jugulaire dans le cou. Ces sondes sont munies à leur extrémité de petites mâchoires très tranchantes commandées de l’extérieur et qui permettent de prélever de très petites quantités de myocarde.
 retour Les différentes interventions
retour Les différentes interventions
5. Exérèse de corps étrangers
Il arrive parfois que des prothèses ou corps étrangers implantés dans les vaisseaux ou dans le cœur ‘larguent leurs amarres’ et se voient transportés par le courant sanguin en des lieux inadéquats, comme le cœur , la circulation pulmonaire et la circulation systémique. C’est le cas par exemple avec des cathéters placés à demeure pour de longs traitements. Des extrémités de cathéters peuvent exceptionnellement se détacher et migrer dans la circulation. Lors du cathétérisme cardiaque interventionnel , des prothèses récemment implantés peuvent migrer dans les vaisseaux ou les cavités cardiaques. Dans la plupart des cas, ces ‘corps étrangers’ peuvent être ôtés sans chirurgie à l’aide de dispositifs endovasculaires spéciaux (lasso, pinces, paniers, etc...). La plupart des prothèses utilisées au cathétérisme cardiaque interventionnel sont d’ailleurs conçues pour être relativement facilement ‘repêchés’. Les électrodes d’un pacemaker hors d’usage, doivent aussi parfois être enlevé par ces techniques.
 retour Les différentes interventions
retour Les différentes interventions
6.Le traitement intracardiaque des troubles du rythme, domaine où la cardiologie a fait d’importants progrès ces dix dernières années. Cette section est décrite dans le chapitre consacré au traitement des troubles du rythme.
 retour Le cathétérisme interventionnel
retour Le cathétérisme interventionnel
Avantages, inconvénients et risques du cathétérisme interventionnel


Les avantages sont évidents: hospitalisation de courte durée, pas de chirurgie, pas de cicatrice, rétablissement rapide. Quand la technique est disponible et efficace, il est raisonnable de la préférer à la chirurgie en première intention.
Inconvénients: Le taux de réussite du cathétérisme cardiaque interventionnel est inférieur à celui de la chirurgie, mais l’échec du cathétérisme cardiaque ne compromet pas pour autant le travail chirurgical. On ne dispose pas du même recul que la chirurgie pour les techniques récentes et nous ignorons si la mise en place des prothèses diverses n’aura pas d’effet négatif à très longue échéance. Le cathétérisme cardiaque traumatise les vaisseaux périphériques (veines et artères par où les cathéters sont introduit) et parfois (rarement) de manière importante.
Risques et complications: Le type, la fréquence et la gravité des complications sont extrêmement variables en fonction de la malformation de l’enfant, du type de l’intervention et de l’état clinique. Pour la plupart des procédures, le risque de complications importantes reste cependant faible mais ceci doit pouvoir être discuté entre parents et cardiologue cathétériseur.
- les vaisseaux qui reçoivent les sondes peuvent se thromboser (se boucher) après le passage parfois pendant de nombreuses heures de gros cathéters. Ceci est surtout problématique chez le très petit enfant pour qui le matériel reste mal adapté, et ceci malgré de gros progrès en la matière.
- l’hémopéricarde ou épanchement de sang dans le péricarde peut survenir suite au traumatisme de la paroi cardiaque (micro-perforation) par les sondes d’intervention. Cette complication peut être rapidement détectée par échocardiographie et traité (drainage péricardique). Il est exceptionnel que le chirurgien doive intervenir pour arrêter le saignement.
- Les sondes peuvent également irriter les voies de conduction électrique et causer ainsi des troubles du rythme, soit de type extrasystoles, tachycardie ou blocs atrioventriculaires. Le retrait des cathéters suffit souvent pour arrêter ces troubles du rythme mais parfois des médicaments ou une stimulation par une sonde de pacemaker peuvent être nécessaires.
- Une complication plus rare est l’embolie, càd l’envoi dans la circulation systémique d’un caillot de sang ou d’une bulle d’air lors des manipulations interventionnelles. Les conséquences dépendent de l’endroit où se loge l’embole. Sans conséquence réelle dans la plupart des organes, l’embole peut provoquer des accidents neurologiques lorsqu’il se loge dans le cerveau. Ces derniers sont souvent légers et transitoires (ce sont de très petits emboles), mais ils peuvent être définitifs, comme une perte de la force motrice dans une moitié du corps (hémiparésie).
- Lors de la mise en place de prothèses, celles-ci peuvent (rarement) migrer. Il est alors souvent possible d’aller les ‘repêcher’ par des techniques endovasculaires.
D’autres complications peuvent survenir mais sont spécifiques du type d’intervention et elles vous seront explicitées par le cardiologue. Grâce à l’amélioration du matériel, à l’accumulation de l’expérience et à l’anticoagulation, ces accidents sont devenus rarissimes, mais l’introduction de nouvelle techniques, toujours plus ambitieuses, font naître de nouveaux risques. Il est dès lors indispensable de pratiquer tout cathétérisme cardiaque interventionnel pédiatrique dans un centre pourvu de chirurgie cardiaque congénitale, dernier recours salvateur en cas de complication sévère.
Le cathétérisme interventionnel n’est pas une chose aisée. Il nécessite du doigté, de l’expérience, un matériel sophistiqué, un équipement radiologique performant et un entourage paramédical et médico-chirurgical spécialisé. Comme la qualité des résultats est proportionnelle au nombre d’interventions et comme le nombre d’indications cardiopédiatriques est limité, il faut concentrer ce genre de pratique médicale dans un minimum de centres d’excellence.
 retour Le cathétérisme interventionnel
retour Le cathétérisme interventionnel