
La chirurgie
Un peu d’histoire…

La chirurgie cardiaque est une spécialité relativement jeune, puisque sa première réussite date du 29 novembre 1944, lorsqu’aux USA Alfred Blalock et Vivien Thomas réalisèrent la première intervention palliative chez une fillette de 15 mois porteuse d’une tétralogie de Fallot. Le crédit intellectuel de cette réalisation revenait à Hélène Taussig, pionnière brillante de la cardiologie infantile moderne qui eut l’idée d’anastomoser (une anastomose ou ‘shunt’ consiste à créer chirurgicalement une communication entre deux vaisseaux) l’artère du bras à l’artère pulmonaire pour accroître le débit sanguin pulmonaire et réduire la cyanose des « enfants bleus », jusque là voués à une mort misérable et précoce. Cette anastomose de Blalock-Taussig a permis de sauver de nombreux enfants en leur permettant d’atteindre l’ère de la chirurgie à cœur ouvert ; elle est d’ailleurs toujours d’actualité lorsqu’il faut pallier une malformation complexe qu’on ne peut corriger en bas âge. Cette chirurgie « à cœur fermé », c’est à dire sans devoir ouvrir le cœur, s’est ensuite développée et il a été possible d’améliorer une série d’anomalies extra, voire intra cardiaques, comme les coarctations de l’aorte, les sténoses pulmonaires etc…
Dans les années 1950, quelques pionniers audacieux (Lillehei 1955, USA) osèrent ouvrir le cœur pour réparer un défaut intracardiaque (une communication interauriculaire) en « anastomosant » la circulation de l’enfant sur celle d’un parent, ce qui permettait d’arrêter le cœur de l’enfant pendant le temps nécessaire à la réparation. C’est alors que débute l’ère de la chirurgie « à cœur ouvert ». Pour des raisons évidentes d’éthique et de biocompatibilité, cette technique de circulation croisée entre enfant et donneur ne pouvait se généraliser et quelques mois plus tard, Gibbon (USA) mettait au point une machine cœur-poumon extracorporelle qui permettait de mettre au repos le cœur et les poumons du patient tout en assurant l’oxygénation des organes vitaux, dont le cerveau. C’est à Kirklin (USA) qu’on doit la première série de correction d’anomalies intracardiaques en utilisant cette technique. Il est rapidement apparu ensuite que le froid relatif pouvait avoir un effet protecteur sur le myocarde et autres organes : depuis lors, beaucoup d’opérations à cœur ouvert se pratiquent sous hypothermie relative.
L’histoire de la chirurgie à l’Université Catholique de Louvain est détaillé dans le chapitre ‘Notre Histoire’.
 retour vers "La chirurgie"
retour vers "La chirurgie"
La chirurgie à cœur ‘ouvert’ ou à cœur ‘fermé’ :
Deux types de chirurgies en fonction des besoins


1. La chirurgie à cœur ouvert ou chirurgie avec circulation extracorporelle:
Lorsque le chirurgien doit intervenir à l’intérieur du cœur, il est nécessaire de faire appel à la circulation extracorporelle (CEC) ou machine cœur-poumon artificielle qui permet d’assurer la circulation et l’oxygénation du sang pendant que le chirurgien travaille sur le cœur. Pour cela, lorsque le thorax est ouvert, le chirurgien dérive hors du corps par un système de tuyaux le sang bleu des 2 veines caves vers un poumon artificiel (une machine où le sang entre en contact avec l’oxygène). Le sang oxygéné (rouge) et refroidi (le plus souvent) par le poumon artificiel est alors propulsé par une pompe (qui joue le rôle du cœur) dans l’aorte. Le circuit de CEC constitue en lui-même un volume considérable qu’il faut « remplir de liquide » avant de le brancher sur la circulation du patient. Ce liquide est en partie fait de sang venant de la banque de sang. Le sang doit être anticoagulé (à l’aide d’héparine) pour éviter la formation de caillots dans les tuyauteries. Quand la CEC est branchée, le cœur et la circulation pulmonaire sont vidés de leur sang ce qui permet de les ouvrir sans perte de sang et sans que le chirurgien soit gêné visuellement par le sang (« chirurgie à cœur ouvert »). La plupart du temps, le cœur devra être arrêté pendant l’intervention (cardioplégie) mais dans certain cas l’opération pourra se faire ‘à cœur battant’. La cardioplégie est obtenue par injection dans les artères coronaires d’une solution froide spéciale. Dans certaines malformations, il est parfois nécessaire d’arrêter un moment la CEC (« arrêt circulatoire total »). Cela est possible pendant de courts instants aux valeurs habituelles de l’hypothermie. Cependant, lorsque l’arrêt circulatoire doit être prolongé, on refroidit davantage le patient, jusqu’à des t° comprises entre 15 et 20°C (« arrêt circulatoire avec hypothermie profonde »). Jusqu’aux années 1980 la technique de CEC était difficilement applicable au nourrisson pour des raisons mécaniques : le dispositif était trop volumineux ; progressivement ont été mis sur le marché des dispositifs de plus en plus miniaturisés et il est désormais possible d’opérer sous CEC des nourrissons de 2 kg, parfois moins. Actuellement, les circuits de CEC sont vendus sous forme d’unités stériles « disposables », ce qui exclut tout risque d’infection ou de contamination et facilite grandement la mise en œuvre.
2. La chirurgie à cœur fermé, sans circulation extracorporelle :
Lorsque le chirurgien doit intervenir sur les vaisseaux en dehors du cœur (aorte, artères pulmonaires) la circulation extracorporelle n’est la plupart du temps pas nécessaire. Le chirurgien clampe alors les vaisseaux sur lesquels il doit travailler, afin d’arrêter temporairement le flux sanguin.
 retour vers "La chirurgie"
retour vers "La chirurgie"
La chirurgie permet-elle de toujours corriger le cœur en une fois?


Malheureusement pas. Certaines interventions seront d’emblée correctrices mais d’autres seront palliatives. Parfois également, des réinterventions doivent être réalisées un temps variable après la correction.
La chirurgie palliative a pour but soit de préparer la chirurgie correctrice parce que cette dernière est trop complexe pour être réalisée en un seul temps (le nom de « chirurgie préparatoire » conviendrait mieux), soit d’améliorer la tolérance chez un enfant dont la malformation cardiaque ou l’état général n’autorisent pas une correction d’emblée.
La chirurgie correctrice peut être réalisée d’emblée (cas d’espèce le plus fréquent) ou après chirurgie préparatoire et/ou palliative. Certaines anomalies (la minorité) se corrigent « à cœur fermé » : canal artériel, coarctation de l’aorte, double arc aortique, etc. Il s’agit bien évidemment d’anomalies vasculaires extracardiaques. Dans tous les cas comprenant des anomalies intracardiaques, il est nécessaire d’ouvrir le cœur et donc de recourir à une CEC. Avec les progrès des soins intensifs du petit nourrisson, la miniaturisation des techniques de CEC et la précision de plus en plus grande des diagnostics, la tendance actuelle est de corriger d’emblée (sans palliation) et en bas âge la plupart des malformations. De nos jours, on peut estimer à 80 % les cardiopathies « en ordre » avant l’âge de 6mois.
Les réinterventions sont pour la plupart prévues et programmées longtemps à l’avance : il s’agit en général de remplacer une prothèse (le plus souvent valvulaire) ou une valve anormale que la chirurgie réparatrice a volontairement laissée en place. Plus rarement, elles sont dues à un fait nouveau imprévisible : endocardite bactérienne, lâchage de suture sur une réparation, récidive d’anomalie, inadaptation de la correction avec la croissance, etc…. Enfin, elles sont parfois le fait de résidus ou séquelles peu invalidants dans l’enfance et dont on préfère réaliser « l’ajustement » après la fin de la croissance. Ces interventions se font en majorité sous CEC. Ces interventions sont techniquement plus difficiles en raison des adhérences créées par le premier temps chirurgical et elles risquent d’être plus longues, mais les résultats sont généralement bons.
Les ré-interventions sont fréquemment mal acceptées par le patient et/ou sa famille, d’autant qu’elles sont pratiquées si possible avant l’apparition des symptômes : le patient admet difficilement d’être à nouveau opéré alors qu’il se sent en parfaite santé. Une aide psychologique à ce moment est parfois nécessaire.
 retour vers "La chirurgie"
retour vers "La chirurgie"
Ce que la chirurgie ne peut encore réparer


En ce début du 21ème siècle, la majorité des cardiopathies congénitales sont réparables, mais il faut apporter un bémol à ce constat. D’abord, une série d’anomalies n’est corrigée que provisoirement : ce sont toutes les malformations dont la réparation nécessite la mise en place d’une prothèse qui devra être remplacée ultérieurement, soit parce qu’elle se dégrade, soit parce qu’elle n’est plus adaptée à la taille de l’enfant. Ensuite, il existe une catégorie d’anomalies qu’on ne peut encore corriger au sens propre, principalement celles où il n’existe qu’un seul ventricule. Certes, on peut réaliser dans ces cas des palliations très efficaces, mais on ne peut parler de guérison totale : le patient n’aura pas la même capacité physique que ses pairs munis de 2 ventricules, et cela peut parfois poser problème, en cas de grossesse par exemple. Il existe aussi des malformations très rares dont le traitement reste problématique : sténoses diffuses des veines pulmonaires, hypertension pulmonaire obstructive, hypoplasie diffuse des artères pulmonaires, etc…
 retour vers "La chirurgie"
retour vers "La chirurgie"
La salle d’opération: une grande équipe devant être guidé par un chef d’orchestre attentif…


La mise en œuvre et la surveillance de la CEC est sous la responsabilité d’un perfusioniste. Il s’agit d’un membre de l’importante équipe paramédicale qui entoure le chirurgien et l’anesthésiste. Son rôle est primordial car toute erreur d’attention peut avoir des conséquences irréversibles pour le patient, comme par exemple l’entrée d’air dans le circuit et les conséquences cérébrales dramatiques que l’on devine. Le perfusioniste doit être formé aux particularités physiologiques de l’enfant et doit travailler en collaboration intime avec le chirurgien. L’anesthésiste reste le chef d’orchestre de l’abord médical du patient pendant la CEC et la chirurgie. En charge de la narcose, c’est lui ou elle qui surveille le monitoring de toutes les fonctions vitales (débit urinaire, ventilation, fonction cardiaque, pertes de sang, température, etc, …) et réagit en conséquence. Son rôle est capital lors de la mise en route de l’intervention, lors du sevrage de la CEC et lors du retour de l’enfant aux soins intensifs. On ne saurait minimiser le rôle de ces acteurs « peu visibles » par le patient ou sa famille. De même pour le rôle des infirmières instrumentistes dont la clairvoyance et l’esprit de décision font qu’un chirurgien peut travailler plus rapidement et avec davantage de sécurité. Le chirurgien lui-même n’est jamais seul, mais aidé d’un assistant chevronné. Dans les anomalies complexes, l’équipe chirurgicale est composée de 2 chirurgiens ayant pratiquement la même expérience. On le voit, il y a souvent pas mal de monde dans une salle d’opération cardiaque pédiatrique, surtout si on y ajoute le cardiologue qui y vient pour faire l’échocardiographie ( échocardiographie transoesophagienne ) pré et post CEC et les différents stagiaires et étudiants. En raison des particularités pédiatriques (petits vaisseaux, état préopératoire parfois instable, etc…), la mise en route de l’anesthésie et de la CEC ainsi que le démontage en fin d’intervention prennent beaucoup de temps. Une intervention sous CEC classique du nourrisson nécessite un séjour en salle d’opération de 4 à 6 heures, alors que la prestation du chirurgien et donc la durée de la CEC dure 30 à 120 minutes. Soulignons que la fermeture du thorax est accomplie hors CEC.
 retour vers "La chirurgie"
retour vers "La chirurgie"
Où est la place des parents dans tout cela ?


Parfois, lorsque l’état de l’enfant est stable, il sera autorisé à un des parents d’entrer en salle d’opération afin d’assister à l’endormissement de l’enfant. Ceci permet souvent à l’enfant d’être plus calme. Ceci peut également ‘rassurer’ les parents mais peut parfois être éprouvant pour eux. Ce n’est donc jamais une obligation. Rester à proximité de la salle d’opération pendant l’intervention, génère par contre beaucoup de stress et d’anxiété, quelque part ‘inutiles’. C’est pour cela que nous conseillons le plus souvent aux parents de sortir de l’hôpital et d’aller s’aérer. Comme la plupart des gens ont actuellement des GSM, le chirurgien les appelle alors en fin d’intervention.
 retour vers "La chirurgie"
retour vers "La chirurgie"
La circulation extracorporelle et ses répercussions


Bien que la procédure soit devenue routinière et que les résultats de la chirurgie cardiaque soient excellents, une intervention sous CEC constitue une agression considérable pour l’ensemble du corps. Il y a tout d’abord l’agression liée à toute intervention ou traumatisme, le stress ou choc opératoire entraînant une réponse métabolique complexe qu’il serait fastidieux de détailler ici. En sus de ce phénomène, la CEC a ses propres conséquences sur l’ensemble des organes. En effet, le circuit de CEC dans lequel circule le sang du patient est immédiatement reconnu par les cellules sanguines comme un corps étranger qu’il convient d’éliminer au plus vite : une réponse immunitaire complexe se met en place accompagnée d’une réaction inflammatoire généralisée qui libère entre autres des substances protéolytiques, des radicaux libres (des toxines en quelque sorte) et des molécules vaso-actives (qui dilate les petits vaisseaux et augmentent leur perméabilité) destinées en principe à préparer le rejet du corps étranger mais qui agissent bien sûr sur l’ensemble des organes et les fragilisent de diverses manières. Enfin, la pompe de CEC fournit un débit de sang non pulsatile, ce qui a des conséquences négatives sur la fonction métabolique des cellules de la paroi des vaisseaux sanguins. Les organes les plus sensibles sont par ordre de sensibilité décroissant le myocarde, le sang, le cerveau, les poumons, les reins, le foie et le tube digestif. Ces effets délétères surviennent à des degrés variables mais sont d’autant plus prononcés que l’intervention et la CEC sont de longue durée (c’est à dire en cas de malformation complexe). Chez le nouveau-né, dont les tissus ne sont pas encore arrivés à maturation, les effets peuvent être plus prononcés. Généralement cependant, le corps réagit favorablement dès l’arrêt de la CEC et il n’y a pratiquement pas de complications significatives. Parmi les complications réversibles les plus fréquentes, citons la baisse de fonction du myocarde, les tendances hémorragiques, l’œdème pulmonaire et l’insuffisance rénale. Grâce au développement de soins intensifs postopératoires performants, ces complications, parfois spectaculaires, sont pour la plupart maîtrisables.
 retour vers "La chirurgie"
retour vers "La chirurgie"
Les abords chirurgicaux

Sauf exception, la chirurgie sous CEC du nourrisson et petit enfant s’effectue par sternotomie médiane : l’incision s’étend donc sur le sternum depuis le début du sternum jusqu’au haut de l’abdomen, là où se termine la cage thoracique. La cicatrice est presque toujours fine et peu visible lorsque les enfants sont opérés tôt dans la vie ; elle peut être plus visible chez le plus grand enfant et l’adolescent où la tendance aux cicatrices chéloïdes (boursouflées) est plus grande. Chez le plus grand enfant certaines corrections sous CEC de ‘petites’ anomalies (communication interauriculaire par ex) peuvent être réalisées par thoracotomie latérale (une incision entre les côtes sur le côté du thorax, plus ou moins vers l’avant ou l’arrière selon les cas) pour raisons esthétiques. La plupart des opérations à cœur fermé se font par thoracotomie latérale.
Dans les anomalies complexes, le patient peut donc avoir 2 à 3 cicatrices. Ces cicatrices sont parfois mal acceptées à l’adolescence, aussi bien chez les filles que chez les garçons. La demande est donc grande pour une chirurgie « sans cicatrice ». De grands efforts sont actuellement faits par les chirurgiens pour faire des incisions (et donc des cicatrices) les plus petites possibles et les plus ‘esthétiques’ possibles. Une technique de mini-thoracotomie existe actuellement, mais elle ne s’applique pas au petit enfant. Elle peut s’appliquer chez le plus grand enfant, n’ayant pas été opéré antérieurement et porteur d’anomalies uniques et simples. La chirurgie par thoracoscopie (c’est à dire en introduisant entre les côtes une optique tubulaire et différents outils télescopiques) se développe mais elle ne convient pas encore chez le petit enfant porteur d’anomalie importante et elle peu praticable s’il y a des adhérences secondaires à des interventions préalables. Mêmes remarques pour la chirurgie par robot. Les problèmes majeurs dans ce type de chirurgie (mini-thoracotomie, thoracoscopie ou robot) appliquée à la pathologie congénitale de l’enfant sont d’une part, la difficulté d’installer de cette manière une CEC chez le petit enfant et d’autre part, l’insécurité d’une réparation extracardiaque et intracardiaque par une voie d’abord minuscule. Pour l’instant, ces techniques sont donc encore expérimentales et rarement proposées chez l’enfant et les complications recensées sont plus fréquentes qu’avec un abord classique.
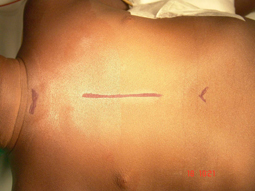 devant (sternotomie),
devant (sternotomie),
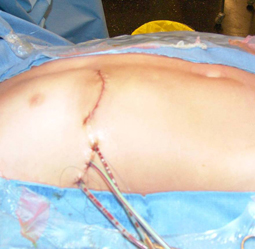 sur le côté (thoracotomie latérale),
sur le côté (thoracotomie latérale),
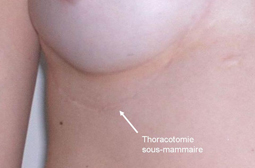 sous le sein (thoracotomie sous-mammaire).
sous le sein (thoracotomie sous-mammaire).
 retour vers "La chirurgie"
retour vers "La chirurgie"
L’insertion de matériel ‘étranger’ : les ‘prothèses’


Bien des malformations cardiaques se caractérisent par absence ou malformation d’une structure essentielle ; il s’agit le plus souvent de ventricules, de valves et de segments artériels. Les ventricules ne peuvent à ce jour pas encore être remplacés ou rajoutés de façon durable. Par contre nous disposons d’un arsenal fort complet de prothèses valvulaires ou vasculaires permettant de se substituer ou remplacer valves et vaisseaux.
Les prothèses valvulaires sont de 2 types : soit les valves mécaniques (entièrement synthétiques), soit les bioprothèses d’origine animale ou humaine.
Les valves mécaniques existent depuis une quarantaine d’années, en de nombreux modèles, principalement destinés au remplacement de la valve aortique ou mitrale. Les prothèses les plus performantes sont en matériaux composites très résistants et sont pratiquement inusables. Elles sont néanmoins très rarement utilisées chez le petit enfant car elles gênent la croissance de leur zone d’implantation et surtout nécessitent un traitement anticoagulant rigoureux, contrainte d’envergure chez le petit. On peut cependant les utiliser avec succès dans les rares cas de remplacement mitral. Notons en effet qu’il n’existe pas de bonne bioprothèse mitrale utilisable chez l’enfant.
Les bioprothèses d’origine animale (hétérogreffes)
Il s’agit de valves aortique ou pulmonaire de mouton ou de porc ou de valve de jugulaire de bovidé (les grosses veines du cou des bovidés sont pourvues de jolies valves à 3 clapets). Ce matériel prélevé sur l’animal est traité pour devenir immunologiquement neutre (pas de rejet) puis est stérilisé et commercialisé. Ce matériel est donc toujours disponible. Il est fréquemment utilisé chez le petit enfant car tous les diamètres sont disponibles, au contraire des homogreffes, plus rares. La durabilité des hétérogreffes est d’autant moins longue que le patient est jeune et elle est généralement inférieure à celle des homogreffes. En raison de leur absence de croissance, les prothèses du tout petit doivent être remplacées périodiquement. Les bioprothèses ne sont plus utilisées pour remplacer les valves aortiques ou mitrales en raison de leur résistance insuffisante dans cette position. On les utilise principalement en position pulmonaire et, plus rarement, tricuspidienne. Elles ne nécessitent pas d’anticoagulation.
Les bioprothèses d’origine humaine ou homogreffes
On peut prélever sur le cadavre humain (dans les quelques heures qui suivent le décès) les valves aortique et pulmonaire et les soumettre à un traitement qui les stabilisent pour ensuite les congeler à basse température et les conserver dans une banque d’organe. Ces homogreffes sont les bioprothèses de choix en cardiologie pédiatrique. Malheureusement, leur disponibilité est limitée en raison du petit nombre de donneurs. Il faut en effet que le donneur soit sain, ce qui limite le recrutement. Selon les nouvelles dispositions légales, on ne doit plus obtenir l’accord éclairé de la famille (si elle ne s’oppose pas spontanément) pour effectuer les prélèvements chez l’adulte si le donneur n’a pas de son vivant fait opposition. Ce n’est pas le cas pour l’enfant et il n’est pas toujours possible d’obtenir un don d’organe d’une famille dont l’enfant vient de mourir. Le nombre d’homogreffes de calibre pédiatrique est donc limité, raison pour laquelle on doit souvent faire appel aux hétérogreffes. Les homogreffes ne nécessitent pas d’anticoagulation et ont une durabilité considérable chez le grand enfant.
Dans certaines circonstances, il y a avantage à utiliser la valve pulmonaire saine du patient même pour remplacer la valve aortique défaillante: on parle alors d’autogreffe. Il va de soi que la mise en place d’une autogreffe s’assortit toujours d’un remplacement de valvule pulmonaire par une autre forme de bioprothèse (en général une homogreffe). L’autogreffe est vivante et va donc continuer à croître, ce qui est intéressant pour la valve aortique, bien plus difficile à remplacer qu’une bioprothèse en position pulmonaire. Cette intervention s’appelle l’intervention de Ross d’après le chirurgien l’ayant décrit.
Les prothèses vasculaires (c’est à dire des tuyaux flexibles) ou conduits existent depuis longtemps et ont fait leur preuve. Il en existe de tous les calibres en différents matériaux, généralement dérivés du nylon (Dacron, Tefflon, Hemashield, Goretex, etc…). Ces prothèses sont utilisées pour reconstruire les artères pulmonaires, l’aorte et ses branches ou pour créer des communications entre les vaisseaux ou entre les ventricules et les vaisseaux. Elles peuvent être munies de valvules prosthétiques mécaniques ou biologiques, et sont alors utilisées pour remplacer l’aorte ascendante et la valve aortique. Ces conduits synthétiques n’exigent pas d’anticoagulation prolongée.
 retour vers "La chirurgie"
retour vers "La chirurgie"